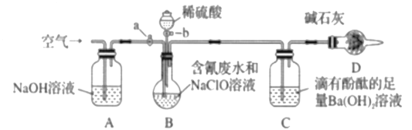
题目内容
【题目】为解决大气中CO2的含量增大的问题,某科学家提出把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,再转变为燃料甲醇的“绿色自由”构想,其部分技术流程如图:
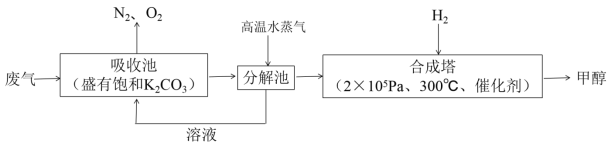
(1) 吸收池中主要反应的离子方程式为____
(2) 合成塔中合成1molCH3OH(g)的反应热是ΔH1,则该反应的热化学方程式为____;工业上CO也可用于合成甲醇,已知:2CO(g)+O2(g)=2CO2(g) ΔH2;2H2(g)+O2(g)=2H2O(g) ΔH3;则CO(g)+2H2(g)=CH3OH(g) ΔH4=____(用ΔH1、ΔH2、ΔH3表示)。
(3) 一定温度下,向2L恒容密闭容器中加入1molCH3OH(g),发生反应CH3OH(g)![]() CO(g)+2H2(g),CO的体积分数随时间的变化如图所示。
CO(g)+2H2(g),CO的体积分数随时间的变化如图所示。
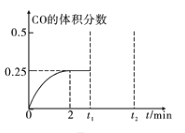
① 反应达到平衡状态的标志是____(填序号)。
A. 气体的密度保持不变
B. 气体的平均摩尔质量保持不变
C . 2v正(H2)=v逆(CO)
D. c(CH3OH):c(CO):c(H2)=1:1:2的时候
E. 气体的体积分数保持不变
② 在该温度下,此反应的化学平衡常数K=______,若在t1时刻再加入1mol CH3OH(g),在t2时刻重新达到平衡,则在t2时刻CO的体积分数____0.25(填“>”、“<”或“=”)。
【答案】CO32-+CO2+H2O=2HCO3- CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH1 ΔH1+![]() ΔH2-
ΔH2-![]() ΔH3 BE 0.25mol2·L-2 <
ΔH3 BE 0.25mol2·L-2 <
【解析】
(1)吸收池中K2CO3溶液吸收CO2,主要反应的离子方程式为CO32-+CO2+H2O=2HCO3-;
(2)合成塔中合成1mol CH3OH(g)的反应热是△H1,其反应的热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H1;根据盖斯定律,CO(g)+2H2(g)═CH3OH(g)△H4=△H1+![]() △H2-
△H2-![]() △H3;
△H3;
(3)①A、气体的密度自始至终保持不变,故A错误;
B、气体的平均摩尔质量M=m/n,反应后混合气体的物质的量增加,M逐渐减小,当M保持不变,达到平衡状态,故B正确;
C、2v正(H2)=v逆(CO),比例关系错误,故C错误;
D、 c(CH3OH):c(CO):c(H2)=1:1:2时,各物质的浓度不一定不变,则反应不一定平衡,故D错误;
E、气体的体积分数是一个变量,当保持不变,反应达到平衡,故E正确;
故选BE;
② CH3OH(g)![]() CO(g)+2H2(g),
CO(g)+2H2(g),
反应前(mol·L-1) 0.5 0 0
变化量(mol·L-1) x x 2x
平衡时(mol·L-1) 0.5-x x 2x
根据平衡时CO的体积分数
x/(0.5+2x)=1/4,x=0.25mol·L-1;
此反应的化学平衡常数K=![]() =0.25mol2·L-2;若在t1时刻再加入1mol CH3OH(g),体积不变,相当于增大压强,平衡向逆反应方向移动,在t2时刻重新达到平衡,CO的体积分数小于0.25;
=0.25mol2·L-2;若在t1时刻再加入1mol CH3OH(g),体积不变,相当于增大压强,平衡向逆反应方向移动,在t2时刻重新达到平衡,CO的体积分数小于0.25;

 灵星计算小达人系列答案
灵星计算小达人系列答案【题目】相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:2SO3(g)![]() 2SO2(g)+O2(g)△H=+197kJ/mol。实验测得起始、平衡时的有关数据如下表:
2SO2(g)+O2(g)△H=+197kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物 质 的量 /mol | 平衡时反应中的能量变化 | ||
SO3 | SO2 | O2 | ||
① | 2 | 0 | 0 | 吸收热量akJ |
② | 0 | 2 | 1 | 放出热 量 bkJ |
③ | 4 | 0 | 0 | 吸收热量ckJ |
下列叙述正确的是( )
A. 达平衡时O2的体积分数:①>③
B. 热量关系:a一定等于b
C. ①②③ 反应的平衡常数:③>①>②
D. ①中的密度不再改变时说明反应已达到平衡状态
【题目】研究NOx、CO、SO2等大气污染气体的治理,对保护环境有重要的意义。回答下列问题:
(1)NOx与CO反应生成无污染气体的相关热化学方程式如下:
①NO2(g)+CO(g)![]() CO2(g)+NO(g) ΔH1=234.0kJ·mol1
CO2(g)+NO(g) ΔH1=234.0kJ·mol1
②4NO(g)![]() 2NO2(g)+N2(g) ΔH2=291.8kJ·mol1
2NO2(g)+N2(g) ΔH2=291.8kJ·mol1
反应③2NO2(g)+4CO(g)![]() N2(g)+4CO2(g)的ΔH3=___kJ·mol1,有利于提高该反应NO2平衡转化率的条件是___(填标号)。
N2(g)+4CO2(g)的ΔH3=___kJ·mol1,有利于提高该反应NO2平衡转化率的条件是___(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)在一定温度下,向2L的恒容密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应:2NO2(g)+4CO(g)![]() N2(g)+4CO2(g),测得相关数据如下:
N2(g)+4CO2(g),测得相关数据如下:
0min | 5min | 10min | 15min | 20min | |
c(NO2)/mol·L1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/mol·L1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①其他条件不变,若不使用催化剂,则0~5minNO2的转化率将___(填“变大”、“变小”或“不变”)。
②以下表述能说明该反应已达到平衡状态的是___。
A.CO的反应速率为N2的4倍
B.气体的颜色不再变化
C.化学平衡常数K不再变化
D.混合气的压强不再变化
③该温度下反应的化学平衡常数K=__(保留两位有效数字)。
④在20min时,保持温度不变,继续向容器中再加入2.0molNO2和2.0molN2,则化学平衡__移动(填“正向”、“逆向”或“不”)。
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。
①CH4还原NO2反应的化学方程式为___。
②在相同条件下,选用A、B、C三种不同催化剂进行反应,生成N2的物质的量与时间变化如图图1所示,其中活化能最大的是___[Ea(A)、Ea(B)、Ea(C)分别表示三种催化剂下该反应的活化能]。
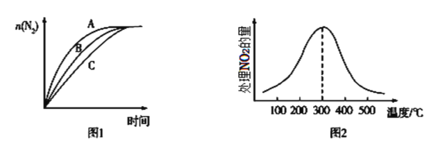
③在催化剂A作用下,测得相同时间内处理NO2的量与温度的关系如图2所示,曲线先增大后减小的可能原因是___。