题目内容
【题目】一种固定烟气中CO2的工艺流程如下:
(1) “反应Ⅰ”中,CO2与过量氨水反应的离子方程式为________。
(2) “反应Ⅰ”中,提高烟气中CO2去除率的可行措施有________(填字母)。
a. 采用高温 b. 加快烟气流速 c. 增大氨水浓度
(3) 若测得滤液中c(CO32-)=10-2 mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。[c(Ca2+)<10-5 mol·L-1时视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
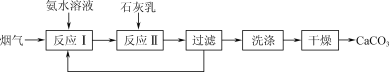
(4) “反应Ⅱ”中,溶液的pH和导电能力变化如图1所示,导电能力初始时快速降低,后来逐渐上升的原因是____________________________________________。
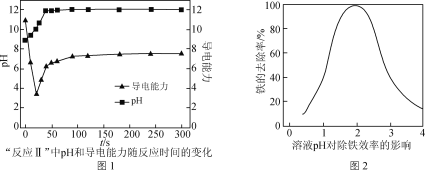
(5) CaCO3可用于调节废水的pH,以除去其中的Fe3+。溶液pH对除铁效率影响如图2所示。
①除铁时应控制溶液的pH为________(填字母)。
a. 0.5~1.5 b. 1.5~2.5 c. 2.5~3.5
② 除铁时pH稍大会生成Fe(OH)3胶体,显著降低除铁效率,其原因是________。
【答案】CO2+2NH3·H2O===2NH![]() +CO
+CO![]() +H2O c 是 初始时快速降低,是由于NH
+H2O c 是 初始时快速降低,是由于NH![]() 、CO
、CO![]() (或HCO
(或HCO![]() )等离子浓度因反应快速降低所致;后来由于氨水的电离及过量Ca(OH)2的电离导致离子浓度增大,导电能力逐渐上升 b Fe(OH)3胶粒小不易过滤;Fe(OH)3胶粒吸附离子带相同电荷相互排斥,导致沉淀速率慢
)等离子浓度因反应快速降低所致;后来由于氨水的电离及过量Ca(OH)2的电离导致离子浓度增大,导电能力逐渐上升 b Fe(OH)3胶粒小不易过滤;Fe(OH)3胶粒吸附离子带相同电荷相互排斥,导致沉淀速率慢
【解析】
该工艺的目的是收集固定烟气中的CO2,先将烟气通入足量的氨水中,通过反应可将其转化为![]() ;再向反应后的溶液中加入石灰乳,石灰乳即Ca(OH)2的悬浊液,因此可再通过反应将
;再向反应后的溶液中加入石灰乳,石灰乳即Ca(OH)2的悬浊液,因此可再通过反应将![]() 转化为CaCO3沉淀,同时也使得氨水再生;将反应后的混合液过滤后,再经过洗涤和干燥即可得到纯度较高的CaCO3。
转化为CaCO3沉淀,同时也使得氨水再生;将反应后的混合液过滤后,再经过洗涤和干燥即可得到纯度较高的CaCO3。
(1)反应Ⅰ中,CO2与过量氨水反应的离子方程式为:![]() ;
;
(2)a.升高温度会降低CO2的溶解,同时也会使氨水挥发,对提高去除率不利,a项不符;
b.加快烟气流速,会使气体与氨水的接触时间缩短,对于吸收CO2不利,b项不符;
c.增大氨水的浓度,可以使得CO2与氨水的反应速率加快,对提高去除率有利,c项符合;
答案选c;
(3)若![]() ,那么溶液中
,那么溶液中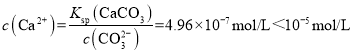 ,Ca2+已经完全沉淀;
,Ca2+已经完全沉淀;
(4)溶液的导电能力与溶液中离子的总浓度以及离子所带的电荷量有关;初始时导电能力快速降低,是由于反应Ⅰ的发生使得![]() 和
和![]() 等离子浓度快速降低所致;后来导电能力又上升,由于反应Ⅰ生成的氨水的电离以及过量的Ca(OH)2电离导致离子的浓度又增加所致;
等离子浓度快速降低所致;后来导电能力又上升,由于反应Ⅰ生成的氨水的电离以及过量的Ca(OH)2电离导致离子的浓度又增加所致;
(5)①由图像可知,pH=2左右,铁的去除率较大,因此除铁时最好将溶液的pH控制在1.5~2.5,b项正确;
②胶体由于分散质粒子直径较小,可以透过滤纸,因此不便过滤;此外,Fe(OH)3胶体颗粒由于带相同的电荷,导致彼此之间相互排斥,难以沉降,这些都对除铁不利。

【题目】温度为T 时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,
反应:PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 250 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s内的平均速率v(PCl3)=0.0032mol/(L·s)
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,该反应为放热反应
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前的v正>v逆
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
【题目】磷酸氯喹(C18H32ClN3O8P2)是当前治疗冠状病毒的药物之一,而碳、氮、氯、磷等是其重要的组成元素。完成下列填空:
(1)碳原子核外有__个轨道;氯原子最外层电子的轨道表示式是__。
(2)属于同主族的两种元素,非金属性大小的关系是__(用元素符号表示)。
(3)已知磷酸是弱电解质,它的分子式为H3PO4。其酸式盐Na2HPO4的电离方程式是__。经测定Na2HPO4的水溶液呈弱碱性,请用学过的化学知识进行解释:__。
(4)常温下,在CH3COONa溶液中加入一定量的HCl,使其pH=7,则c(Cl-)_c(CH3COOH)(填“<”、“>”、“=”)。
(5)向2.0L恒容的密闭容器中充入1.0molPCl5,发生如下反应:PCl5(s)PCl3(g)+C12(g)-124kJ。控制体系温度不变,反应过程中测定的部分数据见下表:
时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
①该条件下平衡常数的表达式为__;前50s内Cl2的反应速率为__。
②要提高上述反应中反应物的转化率,可采取的措施有__、__(任写两点)。
向上述达到平衡③的反应体系中,再加入0.02molPCl3、0.02molC12,则平衡__。移动(选填“正向”、“逆向”、“不”),平衡常数__(选填“增大”、“减小”、“不变”)。
【题目】能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)=CO(g)+3H2(g) △H1
已知:①CH4、H2、CO的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O(l)=H2O(g);△H=+d kJmol-1
则△H1=____(用含字母a、b、c、d的代数式表示)kJmol-1。
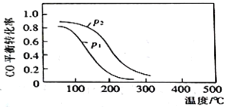
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2____(填“>”“<”或“ = ”)0。
②下列说法正确的是____(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③03min内用CH3OH表示的反应速率v(CH3OH)=____mol L-1·min-1。
④200℃时,该反应的平衡常数K=__。向上述200℃达到平衡的恒容密闭容器中再加入2mol CO、2mol H2、2mol CH3OH,保持温度不变,则化学平衡___(填“正向”、“逆向”或“不”)移动。

