题目内容
0.02 mol FeS2与一定浓度的硝酸完全反应,Fe元素和S元素全部转化为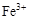 和
和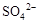 ,同
,同
时产生氮的氧化物(NO、NO2、N2O4)混合气体共0.25 mol,该混合气体的平均相对分子质量可能是
| A.30 | B.46 | C.50 | D.66 |
BC
解析试题分析:根据电子守恒,0.02 mol FeS2,失电子总数:0.02*(1+14)=0.3mol,若产物全是NO,则为0.1mol,不可能。若产物全是NO2,物质的量为0.3mol这与混合气体共0.25 mol不符,不可能。若产物全是N2O4,物质的量为0.15mol这与混合气体共0.25 mol不符,不可能。所以产生气体的相对分子质量应该在(NO,NO2)和(NO2,N2O4)两种情况之间。若为(NO,NO2),设两者物质的量分别为:x,y,则有x+y="0.25,3x+y=0.3,x=0.025" y=0.225,求得M=(0.025*30+46*0.225)/0.25=44.4。若为(NO2,N2O4),设两者物质的量分别为:x,y,则有x+y="0.25,x+2y=0.3,x=0.2" y=0.05,求得M=(0.05*92+46*0.2)/0.25=55.2。即相对分子质量在44.4--55.2之间,故选BC。
考点:本题考查氧化还原反应中运用电子守恒法的相关计算。

以下说法错误的是
| A.物质所含元素化合价升高的反应叫氧化反应 |
| B.金属阳离子在氧化还原反应中不一定作氧化剂 |
| C.含非金属元素的离子,在氧化还原反应中一定作还原剂 |
| D.非金属原子越容易得到电子,其单质氧化性越强 |
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐N。下列有关说法错误的是
| A.该反应的化学方程式为4NH3+3F2→ NF3+3NH4F |
| B.M是极性分子,其还原性比NH3强 |
| C.M既是氧化产物,又是还原产物 |
| D.N中既含有离子键,又含有共价键 |
为了测定铜铁合金中铜的质量分数,在10.00g试样中加入200mL、0.6mol/L的稀硝酸,充分反应后剩余金属7.48g,再向其中加入50mL、0.4mol/L的稀硫酸,充分振荡后剩余金属6.60g。若硝酸的还原产物只有NO,下列说法正确的是
| A.上述测定不能达到实验目的 | B.剩余的7.48g金属为铜 |
| C.共生成NO气体 0.04mol | D.该合金中铜的质量分数为69.2% |
某含铬[Cr2O72-] 废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀干燥后得到n molFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是
| A.消耗硫酸亚铁铵的物的质量为n(2-x)mol |
B.处理废水中Cr2O72- 的物质量为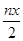 mol mol |
| C.反应中发生转移的电子数为3nx mol |
| D.在FeO·FeyCrxO3中3x=y |
火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2 下列说法正确的是
| A.Cu2S既是氧化产物又是还原产物 |
| B.每生成1 molCu2S,有4mol硫被氧化 |
| C.CuFeS2仅作还原剂,硫元素被氧化 |
| D.每转移1.2 mol电子,有0.2 mol硫被氧化 |
运动会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应为:5KC1O3+6P =3P2O5+5KC1。下列有关该反应的叙述中,正确的是
| A.氯酸钾是还原剂 |
| B.反应中消耗3molP时,转移电子的物质的量为15mol |
| C.KCl既是氧化产物,又是还原产物 |
| D.发令时产生的白烟只是KC1固体颗粒 |
两种大气污染物NO2和SO2在一定条件下可以发生如下反应:NO2+SO2=" NO" +SO3,在体积为V L的密闭容器中通入3molNO2和5molSO2, 反应后容器内氮原子和氧原子个数比为( )
| A.3/10 | B.16/3 | C.3/16 | D.5/16 |