题目内容
火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2 下列说法正确的是
| A.Cu2S既是氧化产物又是还原产物 |
| B.每生成1 molCu2S,有4mol硫被氧化 |
| C.CuFeS2仅作还原剂,硫元素被氧化 |
| D.每转移1.2 mol电子,有0.2 mol硫被氧化 |
D
解析试题分析:A、由反应方程式知在反应中CuFeS2中Cu化合价降低还原为Cu2S、CuFeS2中1/4的S化合价升高,被氧化为SO2;O2在反应后化合价降低,还原为SO2,因此可知SO2既是氧化产物又是还原产物,错误;B、每生成1molCu2S,有1molS被氧化,错误;C、CuFeS2既是氧化剂又是还原剂,错误;利用反应知转移6mole-,有1molS被氧化,D项正确。
考点:考查N、S、Cl、元素及其化合物的性质。

练习册系列答案
相关题目
下列叙述中正确的是
| A.氧化还原反应的实质是元素化合价的升降 |
| B.非金属元素从化合态变为游离态时,该元素一定被氧化 |
| C.氧化剂氧化其他物质时本身一定被还原 |
| D.具有氧化性的物质在反应中一定做氧化剂 |
关于反应CaO + 3C→CaC2 + CO,下面哪种表述能最好地说明该反应是一个氧化还原反应
| A.CaO失氧变为CaC2 |
| B.碳元素失去了电子,同时也得到了电子 |
| C.钙元素的化合价在反应前后发生了改变 |
| D.单质碳的状态发生了变化 |
已知OCN-中每种元素原子都满足8电子稳定结构,反应OCN-+OH-+C12→CO2+N2+C1-+H2O(未配平)中,如果有9 mol C12完全反应,则被氧化的OCN-的物质的量为
| A.2mol | B.3mol | C.4mol | D.6mol |
0.02 mol FeS2与一定浓度的硝酸完全反应,Fe元素和S元素全部转化为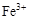 和
和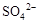 ,同
,同
时产生氮的氧化物(NO、NO2、N2O4)混合气体共0.25 mol,该混合气体的平均相对分子质量可能是
| A.30 | B.46 | C.50 | D.66 |
根据表中信息判断,下列选项不正确的是( )
| 序列 | 参加反应的物质 | 生成物 |
| ① | KMnO4 、H2O2 、H2SO4 | K2SO4 、MnSO4…… |
| ② | Cl2 、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- …… | Cl2 、Mn2+ …… |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比为1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4- > Cl2 > Fe3+ > Br2
水热法制备纳米颗粒Y(化合物)的反应为
3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O,下列说法中不正确的是
| A.a=4 |
| B.Y的化学式为Fe2O3 |
| C.S2O32-是还原剂 |
| D.每有1 mol O2参加反应,转移的电子总数为4 mol |
下列变化中,需加入适当的氧化剂才能完成的是
| A.Fe → FeCl3 | B.CuO → Cu | C.HNO3 → NO | D.SO3 → H2SO4 |
将35.8g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况下)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44L NO(标准状况下),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为
| A.66.4 g | B.50.8 g | C.44.8g | D.39.2g |