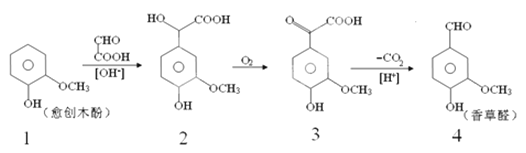
题目内容
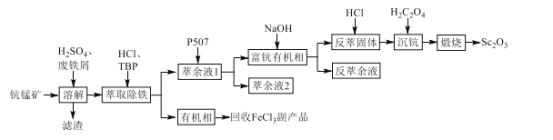
【题目】一种类似钻石的装饰品——锆石(ZrSiO4),其做为装饰品,价格低廉,外观璀璨。天然锆石中常含有Fe、Al、Cu的氧化物杂质,称为锆英石。工业上一种以锆英石为原料制备ZrO2的工艺流程如下:

Ⅰ. Zr在化合物中通常显![]() 价,氯化过程中除C、O元素外,其它元素均转化为其高价氯化物;
价,氯化过程中除C、O元素外,其它元素均转化为其高价氯化物;
Ⅱ.SiCl4极易水解生成硅酸;ZrCl4易溶于水,400℃升华
Ⅲ.Fe(SCN)3难溶于MIBK,Zr (SCN) 4在水中的溶解度小于在MIBK中的溶解度。
请回答下列问题
(1)滤渣1的主要成分是:______________
(2)①“氯化”过程中,锆石(ZrSiO4)发生反应的化学方程式为______________
②ZrCl4产率随温度、压强的变化如图所示,回答问题
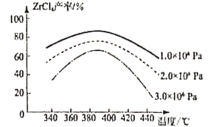
“氯化”过程选择的最佳条件为_______;“氯化”环节产率随温度升高先增大后减小的原因为______
(3)“滤液1”中含有的阴离子,除OH-外还有____________________
(4)①常用的铜抑制剂为NaCN (氰化钠),NaCN可与重金属阳离子反应,生成溶度积较小的沉淀(如Cu(CN)2,Ksp=4×10-10),已知盐酸溶解后的溶液中Cu2+的浓度为1mol/L,若需要溶液中Cu2+浓度等于1.0×10-6 mol/L,则预处理1L该溶液需要1mol/LNaCN溶液的体积为_____________(假设溶液混合后体积可以相加,计算结果保留两位小数)
②由于氰化钠有剧毒,因此需要对“废液”中的氰化钠进行处理,通常选用漂白粉或漂白液在碱性条件下将其氧化,其中一种产物为空气的主要成分,则在碱性条件下漂白液与氰化钠反应的离子方程式为_____________
【答案】Zr (OH) 4 ZrSiO4+4Cl2+4CO=ZrCl4+SiCl4+4CO2 1×106Pa,390℃ 温度升高,化学反应速率加快,相同的时间内生成的产物更多;温度过高,产物升华,产率降低 SiO32-、AlO2-、Cl- 2.06L 2CN-+5ClO-+2OH-=2CO32-+5Cl-+N2↑+H2O
【解析】
天然锆石经过粉碎后,加入CO、Cl2,ZrSiO4反应为ZrC14和SiCl4,其它金属变为FeCl3、AlCl3、CuCl2。加入NaOH后,滤液中含有NaOH、NaCl、NaAlO2、Na2SiO3,沉淀中主要有Fe(OH)3、Zr(OH)4、Cu(OH)2。加入HCl后,Fe(OH)3、Cu(OH)2、Zr(OH)4溶于HCl。加入Cu抑制剂,除去Cu杂质。加入NH4SCN后,Fe3+和Zr4+形成配合物Fe(SCN)3、Zr(SCN)4。加入有机溶剂MIBK,将Zr(SCN)4萃取到有机层,再用H2SO4将Zr(SCN)4萃取到水层,通入NH3,生成Zr(OH)4,煅烧后得到ZrO2。
(1)滤渣1中含有Zr(OH)4、Fe(OH)3、Cu(OH)2,主要成分是Zr(OH)4;
(2)①根据信息,“氯化”过程中,ZrSiO4与氯气、CO反应的生成物中含有ZrC14、SiCl4,同时根据氧化还原反应原理可知生成物中还含有CO2,故反应的化学方程式为ZrSiO4+2Cl2+4CO=ZrC14+SiCl4+4CO2;
②观察图像可知产率最高点时的压强和温度分别是1×106Pa,390℃;“氯化”环节产率随温度升高先增大后减小的原因为温度升高,化学反应速率加快,相同的时间内生成的产物更多;温度过高,产物升华,产率降低;
(3)“滤液1”中含有NaOH、NaCl、NaAlO2、Na2SiO3,阴离子除OH-外还有SiO32-、AlO2-、Cl-;
(4)①沉淀Cu2+需要2 L 1 mol/L NaCN溶液,根据Ksp=c( Cu2+)×c2(CN-),代入Ksp=4×10-10、c(Cu2+)=1.0×10-6 mol/L计算,可得最终混合液中c(CN-)=2.0×10-2mol/L。设所需体积为(2+x)L,则有x=2.00×10-2×(3+x),计算得x≈0.06,所以最终需要2.06 L溶液;
②)漂白液或漂白液的有效成分都含有ClO-,由题意知氮元素氧化生成N2,碳元素氧化生成CO32-, ClO-还原成Cl-,结合原子个数守恒、电子守恒进行配平,发生反应的离子方程式为2CN-+5ClO-+2OH-=2CO32-+5Cl-+N2↑+H2O。

【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有稀 | 试管口出现红棕色气体 | 溶液中的 |
B | 向某钠盐X溶液中加入盐酸,将产生的气体通入 | 有白色沉淀产生 | 反应生成的气体可能为 |
C | 向滴加酚酞的氨水中加蒸馏水稀释 | 溶液红色变浅 | 溶液中所有离子的浓度均减小 |
D | 用铂丝蘸取某溶液在酒精灯火焰上灼烧 | 直接观察,火焰呈黄色 | 溶液中的金属阳离子只有 |
A.AB.BC.CD.D
【题目】下列指定反应的化学用语表达正确的是( )
A | Mg(HCO3)2溶液与足量的NaOH溶液反应 | Mg2++2HCO |
B | 过量SO2通入到NaClO溶液中: | SO2+H2O+ClO-===HClO+ |
C | 向Al2(SO4)3溶液中加入过量的稀氨水 | Al3 ++4NH3·H2O=AlO2—+4NH4++2H2O |
D | KClO碱性溶液与Fe(OH)3反应制取K2FeO4 | 3ClO﹣+2Fe(OH)3=2FeO42﹣+3Cl﹣+4H++H2O |
A. AB. BC. CD. D