题目内容
【题目】已知水在25 ℃和95 ℃时的电离平衡曲线如图所示:
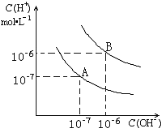
(1)25 ℃时水的电离平衡曲线应为__________ (填“A”或“B”)。
(2)95 ℃时水的离子积Kw=__________,c(H+)=__________
(3)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_____。
(4)95 ℃时,若100 mL pH1=a的某强酸溶液与1 mL pH2=b的某强碱溶液混合后,所得溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是____________。
【答案】A 1×1012 1×10-6mol/L 10∶1 pH1+pH2=14或a+b=14
【解析】
(1)曲线A条件下Kw=c(H+)×c(OH-)=10-7×10-7=10-14,曲线B条件下c(H+)=c(OH-)=10-6mol/L,Kw=c(H+)c(OH-)=10-12;水的电离是吸热过程,加热促进电离,所以A曲线代表25℃时水的电离平衡曲线;
答案为:A。
(2)由图像可知,95℃时,水中氢离子的浓度为1×10-6mol/L,氢氧根离子的浓度为1×10-6mol/L,则Kw=1×10-12;
答案为:1×10-12;1×10-6mol/L
(3)25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)·10-5mol·L-1=V(H2SO4)·10-4mol·L-1,得V(NaOH):V(H2SO4)=10:1;
答案为:10:1;
(4)强酸的pH1=a,强碱的pH2=b,由95℃时,若100体积的某强酸溶液与1体积的某强碱溶液混和后溶液呈中性,即n(OH-)=n(H+),则100×10-a=1×10b-12,102-a=10b-12,即2-a=b-12,则a+b=14或pH1+pH2=14;
答案为:pH1+pH2=14或a+b=14;

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案