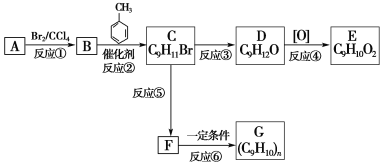
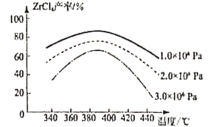
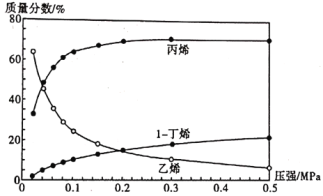
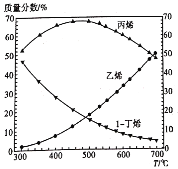
题目内容
【题目】水的电离平衡曲线如图所示。下列说法正确的是
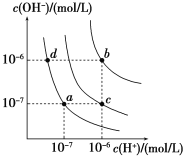
A. 图中对应点的温度关系为a>b>c
B. 纯水仅升高温度,可从a点变到c点
C. 水的离子积常数Kw数值大小关系为b>c>d
D. 在b点对应温度下,0.5 mol/L的H2SO4溶液与1 mol/L的KOH溶液等体积混合,充分反应后,所得溶液的c(H+)=1.0×107 mol·L1
【答案】C
【解析】
A.水的电离是吸热的,温度升高,水的电离平衡正向移动,c(H+) 和c(OH-)都增大,所以温度关系:b>c>a,故A不选;
B.c点c(H+)大于c(OH-),溶液呈酸性,不可能是纯水,故B不选;
C.温度越高,水的离子积越大,故水的离子积常数Kw数值大小关系为b>c>d,故C选;
D. 0.5 mol/L的H2SO4溶液与1 mol/L的KOH溶液等体积混合,两者恰好完全反应,所得溶液呈中性,在b点对应温度下,中性溶液的pH=6,故D不选。
故选C。

练习册系列答案
相关题目
【题目】某同学探究金属Na与CO2的反应,实验如下:
实验I | 实验II | |
操作 | 将点燃的金属钠伸到盛有CO2的集气瓶中 | 将实验I的集气瓶用水冲洗,过滤。取黑色滤渣灼烧;取滤液分别滴加酚酞和氯化钡溶液 |
现象 | ①火焰呈黄色 ②底部有黑色固体,瓶壁上附有白色固体 | ①黑色滤渣可燃 ②滤液能使酚酞溶液变红,滴加氯化钡溶液有白色沉淀生成 |
下列说法不正确的是
A. 生成的黑色固体中含有CB. 白色固体是Na2O
C. 实验说明CO2具有氧化性D. 金属Na着火不能用CO2灭火