题目内容
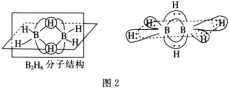
【题目】氧化钪(Sc2O3)是一种稀土氧化物,可用于制作激光、半导体材料。以钪锰矿石(主要含MnO2、SiO2及少量Sc2O3、Al2O3、CaO、FeO)为原料制备Sc2O3的工艺流程如图,其中TBP和P507均为有机萃取剂。
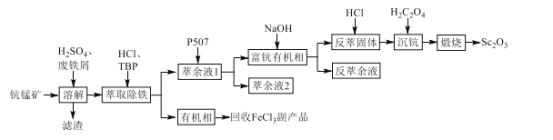
回答下列问题:
(1)Sc2O3中Sc的化合价为___。
(2)“溶解”时铁屑被MnO2氧化为Fe3+,该反应的离子方程式是___。
(3)“滤渣”的主要成分是___。
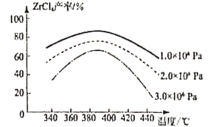
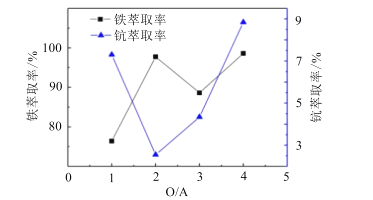
(4)“萃取除铁”时铁和钪的萃取率与O/A比(有机相与水相的体积比)的关系如图所示。该工艺中最佳O/A比为___。
(5)有机萃取剂P507萃取Sc3+的反应原理为阳离子交换:ScCl3+3HR=ScR3+3HCl(HR代表P507)。在“富钪有机相”中反应生成Sc(OH)3的化学方程式是___。
(6)“萃余液2”中的金属阳离子除Al3+、Ca2+外,还有___。
(7)Sc2(C2O4)3在空气中“煅烧”生成Sc2O3的化学方程式是___。
(8)某厂用1000kg的钪锰矿制备Sc2O3,最终得到Sc2O3306g,该矿中含钪的质量分数为___。
【答案】+3 3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O SiO2 2 ScR3+3NaOH=3NaR+Sc(OH)3↓ Mn2+ 2Sc2(C2O4)3+3O2![]() 2Sc2O3+12CO2 0.02%
2Sc2O3+12CO2 0.02%
【解析】
钪锰矿石(主要含MnO2、SiO2及少量Sc2O3、Al2O3、CaO、FeO),加入稀硫酸后,溶液中含有Al3+,Fe2+,Ca2+,Sc3+,再加入Fe,可以将二氧化锰还原为Mn2+,铁被氧化成Fe3+,滤渣中含有SiO2,TBP和HCl加入除去Fe3+,得到有机相和萃余液1,萃余液1加入有机萃取剂P507萃取Sc3+,萃余液2中剩余Al3+、Ca2+、Mn2+,富钪有机相加入氢氧化钠后得到反萃固体Sc(OH)3,加入HCl得到ScCl3,加入H2C2O4后得到Sc2(C2O4)3,在空气中煅烧后Sc2O3,据此分析。
(1)Sc2O3中O的化合价为-2价,根据元素的化合价之和等于0,则Sc的化合价为+3价;
(2)“溶解”时铁屑被MnO2氧化为Fe3+,MnO2还原Mn2+,溶液为酸性,有氢离子参与反应,根据元素守恒补齐生成物水,反应的离子方程式:3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O;
(3)钪锰矿石中不与硫酸和废铁屑反应的物质为二氧化硅,“滤渣”的主要成分是SiO2;
(4)从图中可以看出,萃取除铁时需要将铁的萃取率最高,钪的萃取率最低,此时该工艺中最佳O/A比为2;
(5)在“富钪有机相”中反应生成Sc(OH)3,ScR3与氢氧化钠反应生成Sc(OH)3,化学方程式是ScR3+3NaOH=3NaR+Sc(OH)3↓;
(6)除去铁离子后,“萃余液1”中含有Sc3+,“萃余液2”中的金属阳离子除Al3+、Ca2+外,还有Mn2+;
(7)Sc2(C2O4)3在空气中“煅烧”生成Sc2O3和二氧化碳的化学方程式是2Sc2(C2O4)3+3O2![]() 2Sc2O3+12CO2;
2Sc2O3+12CO2;
(8)某厂用1000kg的钪锰矿制备Sc2O3,最终得到Sc2O3306g,钪元素的质量等于三氧化二钪的质量×钪元素的质量分数![]() ,
,
该矿中含钪的质量分数为![]() 。
。

【题目】纪录片《我在故宫修文物》表现了文物修复者穿越古今与百年之前的人进行对话的职业体验,让我们领略到历史与文化的传承。下列文物修复和保护的过程中涉及化学变化的是( )
A | B | C | D |
|
|
|
|
银器用除锈剂除锈 | 变形的金属香炉复原 | 古画水洗除尘 | 木器表面擦拭烫蜡 |
A.AB.BC.CD.D
【题目】某同学探究金属Na与CO2的反应,实验如下:
实验I | 实验II | |
操作 | 将点燃的金属钠伸到盛有CO2的集气瓶中 | 将实验I的集气瓶用水冲洗,过滤。取黑色滤渣灼烧;取滤液分别滴加酚酞和氯化钡溶液 |
现象 | ①火焰呈黄色 ②底部有黑色固体,瓶壁上附有白色固体 | ①黑色滤渣可燃 ②滤液能使酚酞溶液变红,滴加氯化钡溶液有白色沉淀生成 |
下列说法不正确的是
A. 生成的黑色固体中含有CB. 白色固体是Na2O
C. 实验说明CO2具有氧化性D. 金属Na着火不能用CO2灭火