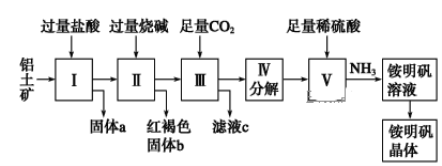
题目内容
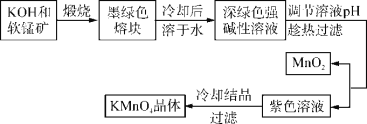
【题目】高锰酸钾是常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。中间产物为锰酸钾。下图是实验室模拟制备KMnO4晶体的操作流程:
已知:锰酸钾(K2MnO4)是墨绿色晶体,其水溶液呈深绿色,这是锰酸根离子(MnO![]() )在水溶液中的特征颜色,在强碱性溶液中能稳定存在;在酸性、中性和弱碱性环境下,MnO
)在水溶液中的特征颜色,在强碱性溶液中能稳定存在;在酸性、中性和弱碱性环境下,MnO![]() 会发生自身氧化还原反应,生成MnO
会发生自身氧化还原反应,生成MnO![]() 和MnO2。
和MnO2。
回答下列问题:
(1)KOH的电子式为____________。
(2)调节溶液pH过程中,所得氧化产物与还原产物的物质的量之比为____________。
(3)趁热过滤的目的是_____________________________________________。
(4)已知20 ℃时K2SO4、KCl、CH3COOK的溶解度分别为11.1 g、34 g、217 g,则从理论上分析,选用下列酸中________(填标号),得到的高锰酸钾晶体纯度更高。
A.稀硫酸 B.浓盐酸 C.醋酸 D.稀盐酸
(5)产品中KMnO4的定量
①配制浓度为0.1250 mg· mL-1的KMnO4标准溶液100 mL。
②将上述溶液稀释为浓度分别为2.5、5.0、7.5、10.0、12.5、15.0(单位:mg·L-1)的溶液,分别测定不同浓度溶液对光的吸收程度,并将测定结果绘制成曲线如下。
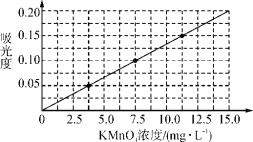
③称取KMnO4样品(不含K2MnO4)0.1250 g按步骤①配得产品溶液1000 mL,取10 mL稀释至100 mL,然后按步骤②的方法进行测定,两次测定所得的吸光度分别为0.149、0.151,则样品中KMnO4的质量分数为________。
(6)酸性KMnO4溶液与FeSO4溶液反应的离子方程式为____________________。
【答案】 ![]() 2∶1 防止析出高锰酸钾,降低产率 C 90.0% MnO
2∶1 防止析出高锰酸钾,降低产率 C 90.0% MnO![]() +5Fe2++8H+===Mn2++5Fe3++4H2O
+5Fe2++8H+===Mn2++5Fe3++4H2O
【解析】软锰矿的主要成分是MnO2,由工艺转化关系可知,MnO2和KOH在空气中熔融煅烧生成锰酸钾(K2MnO4),调节锰酸钾(K2MnO4)强碱溶液的pH,制备KMnO4,通过过滤分离出MnO2,对KMnO4溶液冷却结晶过滤得到KMnO4晶体。
(1)本题考查电子式的书写和仪器的选择,KOH属于离子化合物,其电子式为![]() ,
,
故答案为:![]() ;
;
(2)考查氧化还原反应中得失电子数目守恒,根据信息,锰酸钾在酸性、中性、弱碱性环境中发生歧化反应,MnO2是锰酸钾中Mn由+6价→+4价,化合价降低得到,因此MnO2是还原产物,KMnO4是氧化产物,n(KMnO4)×1=n(MnO2)×2,得出n(KMnO4):n(MnO2)=2:1,
故答案为:2∶1;
(3)考查物质的分离,高锰酸钾溶于水,MnO2不溶于水,因此趁热过滤目的是防止析出高锰酸钾,降低产率;
故答案为:防止析出高锰酸钾,降低产率;
(4)考查物质的分离和提纯,高锰酸钾与浓盐酸反应,因此选项B错误;然后根据三种物质的溶解度大小,溶解度越大,得到高锰酸钾纯度越高,
故选项c正确;
(5)③考查化学计算,吸光度的平均值为(0.149+0.151)/2=0.150,此时对应的KMnO4的浓度为11.25mg·L-1,则1000mL的溶液中KMnO4的浓度为11.25×![]() mg·L-1=112.5mg·L-1,因此高锰酸钾的质量分数为
mg·L-1=112.5mg·L-1,因此高锰酸钾的质量分数为![]() 100%=90.0%;
100%=90.0%;
故答案为:90.0%;
(6)本题考查氧化还原反应方程式的书写,利用高锰酸钾的氧化性,把Fe2+氧化成Fe3+,本身被还原成Mn2+,然后根据化合价的升降法进行配平,即离子反应方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
故答案为:MnO![]() +5Fe2++8H+===Mn2++5Fe3++4H2O。
+5Fe2++8H+===Mn2++5Fe3++4H2O。

【题目】X、Y、Z、W、J是元素周期表前四周期中的五种常见元素![]() 其相关信息如下表:
其相关信息如下表:
元素 | 相关信息 |
X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
Y | M层上有2对成对电子 |
Z | Z和Y同周期,Z的电负性大于Y |
W | W的一种核素的质量数为63,中子数为34 |
J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
![]() 元素X的一种同位素可测定文物年代,这种同位素的符号是 ______ ;
元素X的一种同位素可测定文物年代,这种同位素的符号是 ______ ;
![]() 元素Y位于元素周期表第 ______ 周期第 ______ 族;
元素Y位于元素周期表第 ______ 周期第 ______ 族;
![]() 元素Z的原子最外层共有 ______ 种不同运动状态的电子;
元素Z的原子最外层共有 ______ 种不同运动状态的电子;
![]() 的基态原子核外价电子排布图是 ______ ;
的基态原子核外价电子排布图是 ______ ;
![]() 的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐的化学式为______________ 。
的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐的化学式为______________ 。
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%,质量分数),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO47H2O的工艺流程如下:

(1)实验中需要1 mol/L的硫酸800 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为__________(填写选项字母)
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl ,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有__________,___________。
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法___________________。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤______。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO47H2O
(6)实验中提供的硼镁泥共100 g,得到 MgSO47H2O为172.2 g ,则MgSO47H2O 的产率为___。