题目内容
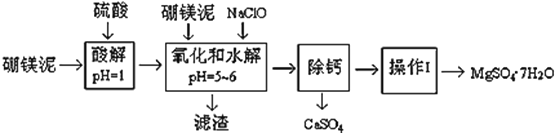
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%,质量分数),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO47H2O的工艺流程如下:
(1)实验中需要1 mol/L的硫酸800 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为__________(填写选项字母)
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl ,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有__________,___________。
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法___________________。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤______。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO47H2O
(6)实验中提供的硼镁泥共100 g,得到 MgSO47H2O为172.2 g ,则MgSO47H2O 的产率为___。
【答案】D2Fe2+ + ClO + 2H+ = 2Fe3+ + Cl + H2OSiO2MnO2取最后一滴滤液,向其中加入硫氰化钾溶液,如果溶液颜色不变红色,说明滤液中Fe3+被除尽;若出现红色,说明没有除尽蒸发浓缩(高温浓缩),趁热过滤过滤 或 过滤洗涤70%
【解析】
硼镁泥中加入硫酸,MgO和CaO、MnO、Fe2O3、FeO、Al2O3都可以和硫酸反应而溶解生成镁离子,钙离子,锰离子,和亚铁离子和铁离子,铝离子,SiO2不溶于硫酸,溶液中加入次氯酸钠会将具有还原性的离子如亚铁离子和锰离子氧化,生成的二氧化锰也不溶于水,存在于滤渣中,调节溶液的pH,使铁离子和铝离子生成沉淀,所以滤渣含有氢氧化铁和氢氧化铝和二氧化硅。利用硫酸镁和硫酸的溶解度随温度的变化分析,硫酸钙的溶解度随着温度升高而降低,所以将溶液加热浓缩,得到高温下的饱和溶液,趁热过滤出硫酸钙,溶液中的溶质几乎全是硫酸镁,然后利用蒸发结晶的方法得到硫酸镁晶体。
(1) 实验中需要1 mol/L的硫酸800 mL,但实际需要配置1000mL溶液,需要的浓硫酸的体积为VmL,则有1×1×98=98%×1.84×V,解v=54.3mL,选择100mL量筒,故选D。(2)溶液中的亚铁离子也可以被次氯酸根离子氧化,离子方程式为:2Fe2+ + ClO + 2H+ = 2Fe3+ + Cl + H2O。(3)通过以上分析,可知二氧化硅不溶于硫酸,在滤渣中存在,次氯酸钠将锰离子氧化成二氧化锰,也存在于滤渣中。 (4)检验溶液中的铁离子利用其与硫氰化钾溶液显红色的性质进行实验,实验操作为:取最后一滴滤液,向其中加入硫氰化钾溶液,如果溶液颜色不变红色,说明滤液中Fe3+被除尽;若出现红色,说明没有除尽。 (5)利用硫酸钙的溶解度随着温度升高而降低的性质,将溶液蒸发浓缩(高温浓缩),趁热过滤出硫酸钙。得到的滤液为硫酸镁饱和溶液,将其蒸发浓缩,冷却结晶,过滤或过滤洗涤,得到硫酸镁晶体。 (6)实验中硼镁泥中氧化镁的质量为100×40=40g,物质的量为1mol,根据镁原子守恒得到硫酸镁晶体的物质的量与氧化镁相等,则硫酸镁晶体的质量为246g,产率为172.2/246= 70%。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案