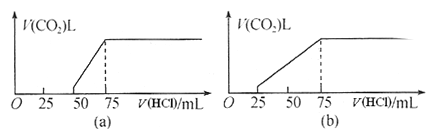
题目内容
【题目】某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾大晶体,具体流程如下:
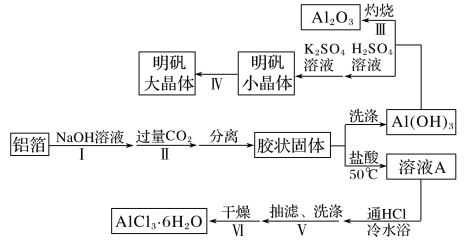
已知:AlCl3·6H2O易溶于水、乙醇及乙醚;明矾在水中的溶解度如下表。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
请回答:
(1)步骤Ⅰ中的化学方程式_________;步骤Ⅱ中生成Al(OH)3的离子方程式___________。
(2)步骤Ⅲ,下列操作合理的是____________。
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)步骤Ⅳ,选出在培养规则明矾大晶体过程中合理的操作并排序_______________。
①迅速降至室温 ②用玻璃棒摩擦器壁 ③配制90℃的明矾饱和溶液 ④自然冷却至室温 ⑤选规则明矾小晶体并悬挂在溶液中央 ⑥配制高于室温10-20℃的明矾饱和溶液
(4)由溶液A制备AlCl3·6H2O的装置如下图:
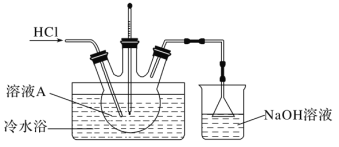
①通入HCl的作用是抑制AlCl3水解和________________________。
②步骤Ⅴ,抽滤时,用玻璃纤维替代滤纸的理由是_____;洗涤时,合适的洗涤剂是_____。
③步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是______________。
【答案】 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- BCD ⑥⑤④ 降低AlCl3溶解度,使其以AlCl3·6H2O晶体形式析出 强酸性环境会腐蚀滤纸 饱和氯化铝溶液 用滤纸吸干
【解析】根据流程图,铝与氢氧化钠反应生成偏铝酸钠,在偏铝酸钠溶液中通入二氧化碳反应生成氢氧化铝胶状沉淀,洗涤后得到氢氧化铝,灼烧得到氧化铝;氢氧化铝用硫酸溶解后与硫酸钾溶液混合,结晶析出明矾晶体;氢氧化铝胶状沉淀用盐酸溶解,生成氯化铝溶液,在氯化氢气流中蒸发得到氯化铝晶体。
(1)步骤Ⅰ中铝与氢氧化钠反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;步骤Ⅱ中偏铝酸钠溶液与二氧化碳反应生成Al(OH)3的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)A.坩埚洗净后,需要擦干,否则灼烧时容易使坩埚炸裂,故A错误;B.为了得到纯Al2O3,需灼烧至恒重,时氢氧化铝完全分解,故B正确;C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳,防止坩埚遇冷炸裂,故C正确;D.热的坩埚取下后放在石棉网上冷却待用,不能放在桌面上,防止灼伤桌面,故D正确;E.为确保称量准确,灼烧后应冷却后称重,故E错误;故选BCD;
(3)步骤Ⅳ中在培养规则明矾大晶体过程中,需要配制高于室温10-20℃的明矾饱和溶液,选规则明矾小晶体并悬挂在溶液中央,自然冷却至室温,让明矾小晶体逐渐长大,故答案为:⑥⑤④;
(4)①通入HCl可以抑制AlCl3水解,增大了溶液中的铝离子浓度,可以降低AlCl3溶解度,使其以AlCl3·6H2O晶体形式析出,故答案为:降低AlCl3溶解度,使其以AlCl3·6H2O晶体形式析出;
②步骤Ⅴ,抽滤时,由于溶液显强酸性,会腐蚀滤纸,因此需要用玻璃纤维替代滤纸,洗涤时,为了减少AlCl3·6H2O晶体的损失,根据AlCl3·6H2O易溶于水、乙醇及乙醚,应该选择饱和氯化铝溶液进行洗涤,故答案为:强酸性环境会腐蚀滤纸;饱和氯化铝溶液;
③AlCl3·6H2O晶体受热容易分解,为得到纯净的AlCl3·6H2O,可以采用滤纸吸干的方式干燥晶体,故答案为:用滤纸吸干。