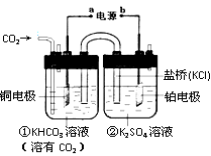
题目内容
【题目】取等物质的量浓度的NaOH溶液两份,每份50mL。向其中分别通入一定量的CO2气体,随后各取溶液10mL,并分别加水稀释到100mL。分别向稀溶液后的溶液中逐滴加入0.1mol/L的盐酸,产生CO2气体的体积(标准状况)与所加入的盐酸的体积之间的关系如下图(a)(b)所示。回答下列问题:
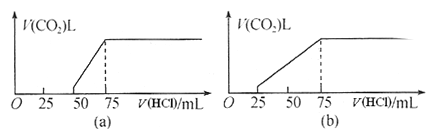
(1)在(a)情况下,溶质为(写化学式)___________,其物质的量之比是__________,标准状况下CO2气体的体积为________。
(2)在(b)情况下,溶质为(写化学式)____________,标准状况下CO2气体的体积为________,原NaOH溶液的物质的量浓度为_________ 。
【答案】 NaOH、Na2CO3 1:1 0.056L NaHCO3 、Na2CO3 0.112L 7.5mol/L
【解析】当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑,
(1)(a)中生成CO2气体至最大,消耗HCl为25mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为50mL-25mL=25mL,由方程式可知NaHCO3和Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaOH、Na2CO3的物质的量之比=25mL:25mL=1:1,根据碳元素守恒可知,从50mL~75mL消耗25mL盐酸时生成的二氧化碳为10mLNaOH溶液通入CO2气体的体积,该阶段生成二氧化碳为0.025L×0.1mol/L=0.0025mol,故10mLNaOH溶液中通入二氧化碳的体积=0.0025mol/L×22.4L/mol=0.056L;(2)(b)中生成CO2气体至最大,消耗HCl为50mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为50mL,而图象中开始生成CO2气体时消耗HCl体积为25mL,说明该阶段只发生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳与NaOH反应后溶液中含NaHCO3、Na2CO3,根据碳元素守恒可知,从25mL~75mL消耗50mL盐酸时生成的二氧化碳为10mLNaOH溶液通入CO2气体的体积,该阶段生成二氧化碳为0.05L×0.1mol/L=0.005mol,故10mLNaOH溶液中通入二氧化碳的体积=0.005mol/L×22.4L/mol=0.112L;(3)加入75mL盐酸时,溶液中溶质都恰好完全反应,此时溶液为NaCl溶液,根据守恒可知10mL溶液中n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.1mol/L=0.0075mol,故原氢氧化钠溶液的浓度==0.75mol/L,故答案为:0.75mol/L。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案【题目】某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾大晶体,具体流程如下:
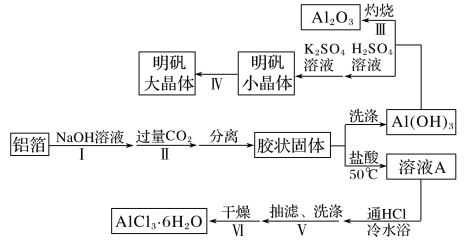
已知:AlCl3·6H2O易溶于水、乙醇及乙醚;明矾在水中的溶解度如下表。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
请回答:
(1)步骤Ⅰ中的化学方程式_________;步骤Ⅱ中生成Al(OH)3的离子方程式___________。
(2)步骤Ⅲ,下列操作合理的是____________。
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)步骤Ⅳ,选出在培养规则明矾大晶体过程中合理的操作并排序_______________。
①迅速降至室温 ②用玻璃棒摩擦器壁 ③配制90℃的明矾饱和溶液 ④自然冷却至室温 ⑤选规则明矾小晶体并悬挂在溶液中央 ⑥配制高于室温10-20℃的明矾饱和溶液
(4)由溶液A制备AlCl3·6H2O的装置如下图:
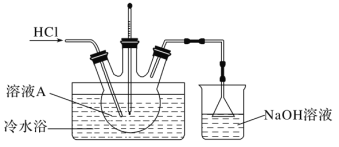
①通入HCl的作用是抑制AlCl3水解和________________________。
②步骤Ⅴ,抽滤时,用玻璃纤维替代滤纸的理由是_____;洗涤时,合适的洗涤剂是_____。
③步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是______________。
【题目】饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As( Ⅲ)亚砷酸盐和As(V)砷酸盐形式存在。
(1)砷与磷为同一主族元素,磷的原子结构示意图为___________________。
(2)根据元素周期律,下列说法正确的是____________________(填字母代号)。
a.最高价氧化物对应水化物的酸性:S>P>As b. 原子半径:S>P>As c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为_________________________。
(4)去除水体中的砷,可先将As(Ⅲ )转化为As(V),选用NaClO可实现该转化。
已知:投料前水样pH=5.81,0.1 mol/L NaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸。
研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:
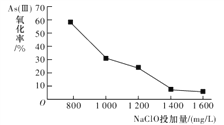
产生此结果的原因是_________________________。
(5)强阴离子交换柱可以吸附以阴离子形式存在的As(V),从而达到去除As的目的。
已知:一定条件下,As(V)的存在形式如下表所示:
pH | <2 | 2~7 | 7~11 | 11~14 |
存在形式 | H3AsO4 | H2AsO4- | HAsO42- | HAsO42-、AsO43- |
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是_____________________。