题目内容
8.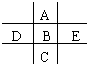 如图为周期表的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高正价是最低负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:
如图为周期表的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高正价是最低负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:(1)A、B、C、D、E五种元素中,原子半径最小的是(写元素符号)O,
A、B、E三种元素的阴离子中,离子半径最大的是(写离子符号)S2->Cl->O2-
(2)写出B、D、E最高氧化物对应水化物的化学式:BH2SO4、DH3PO4、EHClO4.其中酸性最强的物质的名称是HClO4
(3)写出A、B、C所形成气态氢化物的化学式:AH2O、BH2S、CH2Se.其中最稳定的氢化物的电子式是
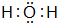 .
.(4)D和E组成的可以组成两种化合物,其中一种化合物中各原子最外层都满足8电子结构,这种化合物的分子式是PCl3.
(5)写出E的单质与B的氢化物反应的化学方程式H2S+Cl2=S+2HCl.
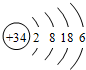
(6)C元素处在长周期的第四周期ⅥA族,其原子结构简图为
 .
.
分析 B元素的最高正价是最低负价绝对值的3倍,则最高正价为+6价,它的最高氧化物为BO3,其中含氧60%,设B的相对原子质量为M,则有$\frac{M}{M+16×3}$=40%,解得M=32,则B为S元素,可推知A为O元素,D为P元素,E为Cl元素,C为Se元素,根据元素周期律的递变规律判断对应化合物的性质.
解答 解:B元素的最高正价是最低负价绝对值的3倍,则最高正价为+6价,它的最高氧化物为BO3,其中含氧60%,设B的相对原子质量为M,则有$\frac{M}{M+16×3}$=40%,解得M=32,则B为S元素,可推知A为O元素,D为P元素,E为Cl元素,C为Se元素.
(1)同周期自左而右原子半径减小、同主族自上而下原子半径增大、电子层越多原子半径越大,故上述元素中O原子半径最小,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->Cl->O2-,
故答案为:O;S2->Cl->O2-;
(2)B、D、E最高氧化物对应水化物分别为:H2SO4、H3PO4、HClO4,同周期元素从左到右元素的非金属性逐渐增强,对应最高价氧化物的水化物的酸性逐渐增强,则酸性最强的为HClO4,
故答案为:H2SO4;H3PO4;HClO4; HClO4;
(3)A、B、C所形成气态氢化物H2O、H2S、H2Se,同主族元素从上到下元素的非金属性逐渐减弱,非金属性越强,对应的氢化物越稳定,则最稳定的是H2O,电子式为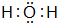 ,
,
故答案为:H2O;H2S;H2Se;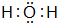 ;
;
(4)D为P元素,E为Cl元素,化合物中各原子最外层都满足8电子结构,则为PCl3,故答案为:PCl3;
(5)Cl2具有强氧化性,与H2S反应生成S和HCl,反应的方程式为H2S+Cl2=S+2HCl,故答案为:H2S+Cl2=S+2HCl;
(6)C为Br元素,处在长周期的第四周期ⅥA族,其原子结构简图为  ,故答案为:四;ⅥA;
,故答案为:四;ⅥA; .
.
点评 本题考查位置结构性质的相互关系,题目难度中等,注意根据元素在周期表中的位置结合化合价特点进行推断的方法.

| A. | 福尔马林可作食品的保鲜剂 | |
| B. | 苯酚有毒,但可用于杀菌消毒 | |
| C. | 聚乙烯塑料制品可用于食品的包装 | |
| D. | 食醋的主要成分是醋酸,它是一种弱酸 |
| A. | Th元素的质量数是232 | B. | 230Th和232Th的化学性质相同 | ||
| C. | 232Th转化成233U是化学变化 | D. | Th元素的相对原子质量是231 |
①用酒精洗涤试管内壁上残留的碘②用酒精洗涤试剂瓶中残留的苯酚③用稀氨水洗涤试管壁上银镜④用热碱液洗涤试管内壁上的油脂.
| A. | ①③④ | B. | ②③④ | C. | ①②④ | D. | ①②③④ |
| A. | 0.08mol/L | B. | 0.08mol/(L•s) | C. | 0.04mol/(L•min) | D. | 0.04 mol/(L•s) |
(1)配制待测溶液,将4.21g含有少量不与盐酸反应的杂质的NaOH固体配成250.00mL待测液,需用到的仪器有烧杯、玻璃棒、胶头滴管、250mL 容量瓶.
(2)把0.4mol•L-1的标准盐酸溶液注入洁净的酸式滴定管中,使液面刻度在“0”以上,固定后,轻轻旋转活塞使滴定管尖嘴部分充满溶液,然后调整液面保持在0刻度或0刻度以下,记下读数;用碱式滴定管向锥形瓶中加入20.00mL待测溶液,并加几滴甲基橙作指示剂.
(3)实验数据
| 试验编号 | 待测液的体积(mL) | 滴入0.4000mol•L-1盐酸的体积(mL) | |
| 滴定前(mL) | 滴定后(mL) | ||
| 1 | 20.00 | 2.10 | 22.00 |
| 2 | 20.00 | 0.90 | 21.00 |
(4)误差分析,若滴定前仰视酸式滴定管读数,终点读法正确,其测得结果偏低(偏高、偏低)

 汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源.
汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源. 2NO;汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因温度升高,反应速率加快.
2NO;汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因温度升高,反应速率加快.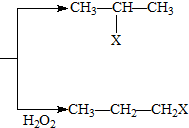 (X为卤素原子)
(X为卤素原子)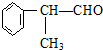 的物质,该物质是一种香料.
的物质,该物质是一种香料.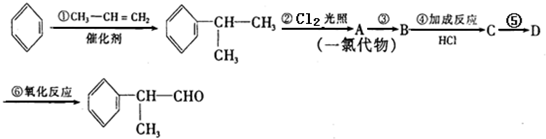
 .
.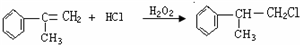 .
.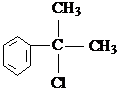 的水解产物
的水解产物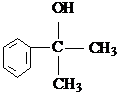 不能经氧化反应⑥而得到产品.
不能经氧化反应⑥而得到产品.