题目内容
18.室温下,三种中学化学常见的单质A、B、C分别为固体、黄绿色气体和无色气体,在一定条件下它们的反应如下:
请回答:
(1)C的化学式为H2,它在充满B气体的集气瓶中燃烧时的现象是:剧烈燃烧,苍白色火焰;
(2)写出反应①的化学方程式:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
(3)写出反应③的离子方程式:Fe+2H+═Fe2++H2;
(4)D、E、F三种物质的水溶液中均含有一种相同的主要阴离子是Cl-,检验该阴离子所用的试剂是硝酸酸化的AgNO3溶液.
分析 B是黄绿色气体,故B是氯气,A和B生成D,D是氯化物,D溶于水得黄色溶液,D含有铁离子,则D是氯化铁,A是铁,氯气和C反应生成E,E溶于水得无色溶液,无色溶液和A反应,生成F和C,则C是氢气,E是氯化氢,铁与盐酸反应生成F为氯化亚铁,据此答题.
解答 解:B是黄绿色气体,故B是氯气,A和B生成D,D是氯化物,D溶于水得黄色溶液,D含有铁离子,则D是氯化铁,A是铁,氯气和C反应生成E,E溶于水得无色溶液,无色溶液和A反应,生成F和C,则C是氢气,E是氯化氢,铁与盐酸反应生成F为氯化亚铁,
(1)通过以上分析知,C是氢气,C的化学式为H2,氢气在充满氯气体的集气瓶中燃烧时的现象是剧烈燃烧,苍白色火焰,
故答案为:H2;剧烈燃烧,苍白色火焰;
(2)反应①的化学方程式为2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
故答案为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
(3)反应③的离子方程式为Fe+2H+═Fe2++H2,
故答案为:Fe+2H+═Fe2++H2;
(4)D是氯化铁,E是氯化氢,F为氯化亚铁,三种物质的水溶液中均含有一种相同的主要阴离子是 Cl-,检验Cl-离子所用的试剂是硝酸酸化的AgNO3溶液,
故答案为:Cl-;硝酸酸化的AgNO3溶液.
点评 本题以元素化合物的推断为载体考查了元素化合物的性质,能正确推断元素化合物是解本题的关键,注意氯离子的检验是高考的热点,铁在氯气中燃烧时,无论铁是否过量都生成氯化铁,为易错点.

练习册系列答案
相关题目
8.关于卤族元素的性质的叙述不正确的是( )
| A. | 它们的原子核外电子层数随核电荷数的增加而增多 | |
| B. | 原子的最外层电子数都是7个 | |
| C. | 它们的单质的颜色随核电荷数的增加而加深 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而增强 |
9.同主族元素形成的同一类型化合物,往往其结构和性质相似.PH4I是一种白色晶体,下列对PH4I的叙述中,正确的是( )
| A. | 它是一种共价化合物 | B. | 它不可能与NaOH溶液反应 | ||
| C. | 它既含离子键又含共价键 | D. | 它受热时不会分解 |
6.下列关于元素的叙述正确的是( )
| A. | 金属元素与非金属元素能形成共价化合物 | |
| B. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| C. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| D. | 多电子原子中,在离核较近的区域内运动的电子能量较高 |
13.下列各项中表达正确的是( )
| A. | 第三周期元素形成的最高价氧化物对应的水化物中,酸性最强的是HClO4 | |
| B. | 水分子很稳定性是因为水分子间易形成氢键 | |
| C. | 用电子式表示HCl形成过程:H-+${\;}_{\;}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$→H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| D. | 第VⅡA族元素形成的氢化物中沸点最高的是HI |
10.温度为500℃时,反应4NH3+5O2=4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v(x)为( )
| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.08mol/(L•s) | ||
| C. | v(H2O)=0.002mol/(L•s) | D. | v(NH3)=0.002mol/(L•s) |
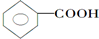 ②CH3CH2CH(CH3)CH3 ③CH4 ④
②CH3CH2CH(CH3)CH3 ③CH4 ④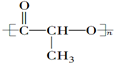 ⑤
⑤ ⑥
⑥ ⑦
⑦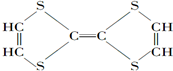
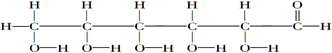
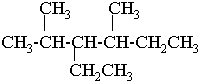
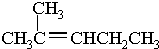 .
. 由图中的实验装置可用于制取乙炔,请回答
由图中的实验装置可用于制取乙炔,请回答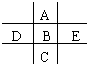 如图为周期表的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高正价是最低负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:
如图为周期表的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高正价是最低负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题: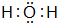 .
. .
.