题目内容
3.臭氧比氧气具有更强的氧化性.可将氧气通过高压放电管来制取臭氧:3O2$\stackrel{放电}{→}$2O3(1)若上述反应的转化率为30%,所得混合气的平均摩尔质量为35.6(保留一位小数),若上述反应的转化率增至40%,则混合气的平均摩尔质量增大(填增大、不变、减小).
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为3L.
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g.则原混合气中臭氧的体积分数为50%.
分析 (1)先根据转化率,利用方程式计算出各自的物质的量,然后根据平均摩尔质量等于气体的总质量与总物质的量之比;反应正向进行,混合气体的质量不变,物质的量减小;
(2)根据气体差量,利用差量法计算生成臭氧的体积;
(3)根据0.896L混合气体物质的量为$\frac{0.896L}{22.4L/mol}$=0.04mol,气态全部参与反应,根据氧气、臭氧的总质量、总物质的量列方程计算各自物质的量,进而计算臭氧的体积分数.
解答 解:(1)假设有1molO2,反应的转化率为30%,发生反应的O2为:1mol×30%=0.3mol,
3O2 $\stackrel{通电}{→}$ 2O3
开始 1mol 0
反应 0.3mol 0.2mol
平衡 0.7mol 0.2mol
故反应后所得气体为0.2molO3和0.7molO2,平均摩尔质量为M=$\frac{0.7mol×32g/mol+0.2mol×48g/mol}{0.7mol+0.2mol}$=35.6 g/mol; 反应正向进行,混合气体的质量不变,物质的量减小,所以平均摩尔质量增大;
案为:35.6;增大;
(2)3O2 $\stackrel{放电}{→}$2O3 △V
2 1
V(O3) (8-6.5)L=1.5L
解得:V(O3)=2×1.5 L=3L;
故答案为:3;
(3)0.896L混合气体物质的量为$\frac{0.896L}{22.4L/mol}$=0.04mol,反应后固体质量增重21.6g-20g=1.6g,气态全部参与反应,设氧气、臭氧的物质的量分别为xmol、ymol,根据二者总质量、总物质的量,则:$\left\{\begin{array}{l}{x+y=0.04}&{\;}\\{32x+48y=1.6}&{\;}\end{array}\right.$
解得:x=0.02,y=0.02,故臭氧的体积分数为$\frac{0.02mol}{0.04mol}$×100%=50%,
故答案为:50%.
点评 本题主要考查混合物计算,涉及差量法、原子守恒法的运用,难度中等.

 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案Ⅰ.如图是实验室中制备气体或验证气体性质的装置图
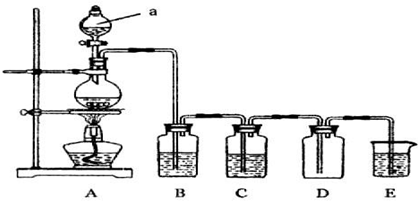
(1)写出用A制取氯气的化学方程式MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O.
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+,则装置B中的溶液的作用是除去氯气中的氯化氢;装置D中加的最佳试剂是(填序号)c:
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在如图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
此时,B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的酸性高锰酸钾(填溶液名称),E中加入Na2SiO3溶液(填化学式).
(4)证明碳元素的非金属性比硅元素的强的现象为D中高锰酸钾溶液不褪色,E中溶液变浑浊;
实验2不严谨之处应如何改进将烧杯换成洗气瓶,右端连接盛有碱石灰的干燥管.
Ⅱ、向烧碱和Na2SO3的混合溶液中加入少量溴水,振荡后溶液变为无色.反应后的溶液中含有大量的SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告.
限选试剂:2mol/LHCl,1mol/L H2SO4,l mol/LBaCl2,l mol/LBa(NO3)2,0.1mol/LAgNO3,CCl4,新制饱和溴水,新制饱和氯水.
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 在试管A中加入少量待测液,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色. | 溶液分层,下层呈橙红色,证明待测液中含Br-. |
| 步骤② | 在试管B中加入少量待测液,加入过量的2mol/L盐酸,再滴加1mol/L BaCl2溶液 | 有白色沉淀生成, 证明待测液中含SO42-. |
| 步骤③ | 在试管C中加入少量待测液,滴加2mol/LHCl至溶液呈酸性,加入几滴新制饱和溴水(填试剂),振荡. | 溴水褪色, 证明待测液中含SO32-. |
| 序号 | 被提纯物(杂质) | 试剂 |
| ① | CH3CH3( CH2=CH2) | |
| ② | CH2=CH2(SO2) | |
| ③ | 乙酸乙酯 (乙酸) | |
| ④ | 乙醇(水) |
| A. | 向氯水中加入亚硫酸钠溶液,氯水褪色 | |
| B. | 通常状况下,干燥的氯气可以使干燥的有色布条褪色 | |
| C. | 纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状;光照H2和Cl2的混合气体时,因迅速化合而爆炸 | |
| D. | 氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸 |
| A. | 分液时,分液漏斗的上层液体应由上口到出 | |
| B. | 用重结晶法分离碳酸钠和碳酸氢钠两种固体 | |
| C. | 配置0.1000 mol•L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| D. | 检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 |
| A. | 常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0 | |
| B. | 在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 | |
| C. | 加热0.1 mol•L-1Al2(SO4)3溶液,Al3+水解程度增大,溶液的酸性增强 | |
| D. | 常温下,pH=11的NaOH溶液与pH=3的醋酸等体积混合后所得溶液显酸性 |

| A. | a、b是同一种物质 | B. | a、b的分子式都是C14H14 | ||
| C. | 上述变化是化学变化 | D. | a、b都是苯的同系物 |