题目内容
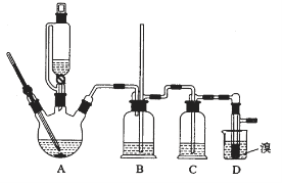
【题目】为探究某无结晶水的正盐X(仅含有两种短周期元素)的组成和性质,设计并完成下列实验。(气体体积已转化为标准状况下的体积)
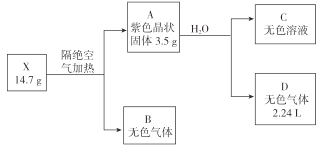
已知:B是空气的主要成分之一;C是一种强碱,且微溶于水 ,载人宇宙飞船内常用含 C的过滤网吸收宇航员呼出的CO2,以净化空气;D遇湿润的红色石蕊试纸变蓝。
(1)X的化学式为 __________________ 。
(2)图中B的组成元素在元素周期表中的位置是______________。
(3)A的电子式为 ____________。
(4)X受热分解转变成 A 和 B 的化学反应方程式为 ____________。
【答案】LiN3 第2周期VA族 ![]() 3LiN3
3LiN3![]() Li3N+4N2↑
Li3N+4N2↑
【解析】
B是空气的主要成分之一,B为氮气或氧气;C是一种强碱,且微溶于水,C为LiOH,载人宇宙飞船内常用含 C的过滤网吸收宇航员呼出的CO2,以净化空气,LiOH与反应生成Li2CO3;D遇湿润的红色石蕊试纸变蓝,D是NH3,确定B为氮气,NH3是2.24L合0.1mol,A中N为14g·mol-1×0.1mol=1.4g。A为Li3N,3.5g中Li为3.5-1.4=2.1g,14.7gX中Li为 2.1g,n(Li)=![]() =0.3mol,n(N)=
=0.3mol,n(N)=![]() =0.9mol,n(Li):n(N)=0.3:0.9=1:3,X的化学式为:LiN3。
=0.9mol,n(Li):n(N)=0.3:0.9=1:3,X的化学式为:LiN3。
(1)由分析可知:X的化学式为LiN3。故答案为:LiN3;
(2)B为氮气,组成元素N在元素周期表中的位置是第2周期VA族。故答案为:第2周期VA族;
(3)A为Li3N,Li最外层只有1个电子,显+1价,N最外层5个电子,得三个电子,显-3价,电子式为![]() 。故答案为:
。故答案为:![]() ;
;
(4)由分析X的化学式为:LiN3,X受热分解转变成 Li3N 和 N2,由质量守恒:化学反应方程式为 3LiN3![]() Li3N+4N2↑。故答案为: 3LiN3
Li3N+4N2↑。故答案为: 3LiN3![]() Li3N+4N2↑。
Li3N+4N2↑。