题目内容
【题目】氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法。
(1)目前,应用最广泛的烟气氮氧化物脱除技术是NH3催化还原法,化学反应可表示为:2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g)△H<0
①该反应中,反应物总能量_______(填“>”、“<”或“=”)生成物总能量。
②当该反应有2mol N2(g)生成时,转移电子的物质的量为________mol。
③该反应中,还原剂为_______(填化学式),氧化产物与还原产物的质量比为_______。
(2)也可以利用甲烷催化还原氮氧化物,已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol ;CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H2=-867kJ/mol
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是_______。
(3)锌锰干电池是应用最普遍的电池之一(如图所示),总反应方程式为: Zn+2MnO2+2NH4Cl=ZnCl2+2NH3↑+Mn2O3+H2O
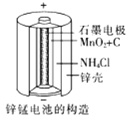
①锌锰干电池的负极材料是________,
②负极发生的电极反应方程式为:_______
③正极发生的电极反应方程式为:________。
④若反应消耗32.5 g负极材料,则电池中转移电子的数目为_______。
【答案】> 6 NH3 1:1 CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H =-1160kJmol-1 锌 Zn-2e-=Zn2+ 2![]() +2MnO2+2e-=2NH3+Mn2O3+H2O NA或6.021023
+2MnO2+2e-=2NH3+Mn2O3+H2O NA或6.021023
【解析】
(1)①△H<0,反应为放热反应,反应物总能量大于生成物总能量;
②根据化合价升高的数值=化合价降低数值=转移电子数;
③还原剂是失电子,元素的化合价升高的,氨气中氮元素化合价-3价升高为0价,故NH3做还原剂;2NH3被氧化得到1mol氧化产物N2,所以还原产物氮气物质的量为1mol,氧化产物与还原产物的质量比为1:1;
(2)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H2=-867kJ/mol
由盖斯定律计算②×2-①即可得到目标方程。
(3)从总反应式Zn+2MnO2+2NH4Cl=ZnCl2+2NH3↑+Mn2O3+H2O看出,锌元素化合价从0升至+2,失电子,为负极材料;负极反应式为Zn-2e-=Zn2+;再用总反应-负极反应式即得正极反应式;32.5g锌是0.5mol,由理论值和实际值的比例关系,可得转移的电子数。
(1)①△H<0,反应为放热反应,反应物总能量>生成物总能量;
②根据化合价升高的数值=化合价降低数值=转移电子数,化合价升高情况:2NH3~6e-~N2,所以当有2mol N2生成,该反应的电子转移的量是6mol;
③反应中氨气中氮元素化合价-3价升高为0价,失电子做还原剂被氧化得到氧化产物N2,2NH3被氧化得到1mol氧化产物N2,所以还原产物氮气物质的量为1mol,氧化产物与还原产物的质量比为1:1;
(2)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H2=-867kJ/mol
由盖斯定律计算②×2-①得到:
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol;
(3)①负极发生氧化反应,锌失电子,则锌锰干电池的负极材料是锌;
②负极电极反应式为:Zn-2e-=Zn2+;
③正极反应式=总反应式-负极反应式,即2![]() +2MnO2+2e-=2NH3+Mn2O3+H2O;
+2MnO2+2e-=2NH3+Mn2O3+H2O;
④32.5g锌是0.5mol,而1mol的锌失去2mol的电子,所以转移电子的物质的量为1mol,数目为NA或6.02×1023。

 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案