题目内容
【题目】金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池在碱性环境下的总反应方程式为:4M+nO2+2nH2O=4M(OH)n。已知:电池的“理论比能量”指单位质量电极材料理论上释放出的最大电能。下列说法不正确的是( )
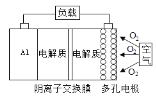
A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属-空气电池,Al-空气电池的理论比能量最高
C. M-空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D. 消耗氧气22.4 L(标准状况),有4 molOH-从右往左通过阴离子交换膜
【答案】C
【解析】
A.反应物接触面积越大,反应速率越快,所以采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面,从而提高反应速率,A正确;
B.电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,则单位质量的电极材料失去电子的物质的量越多则得到的电能越多,假设质量都是1g时,这三种金属转移电子物质的量分别为1/12 mol、1/9 mol、1/32.5 mol,所以Al-空气电池的理论比能量最高,B正确;
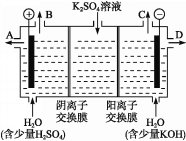
C.正极上氧气得电子和水反应生成OH-,因为是阴离子交换膜,所以阳离子不能进入正极区域,则正极反应式为O2+2H2O+4e-=4OH-,C错误;
D.标准状况下22.4L氧气是1mol,根据C中分析可知生成4molOH-,原电池中阴离子向负极移动,铝是负极,则有4molOH-从右往左通过阴离子交换膜,D正确;
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列关于物质分类的正确组合是( )
混合物 | 氧化物 | 含氧酸 | 碱 | 盐 | |
A | 空气 | SiO2 | H2SO4 | Na2CO3 | NaHCO3 |
B | 冰水混合物 | Na2O | NaHSO4 | NaOH | NaCl |
C | 水煤气 | CuO | HCl | NH3 . H2O | CaF2 |
D | 盐酸 | Na2O2 | HNO3 | Ca(OH)2 | CaCO3 |
A.A
B.B
C.C
D.D
【题目】某硫酸工业废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等。回收废渣中金属元素的工艺流程如下:
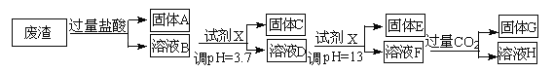
已知常温条件下:
①阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol·L-1 )时的pH 如下表所
示。
阳离子 | Fe3+ | Al3+ | Mg2+ |
开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
恰好完全沉淀时的pH | 3.2 | 5.2 | 11.0 |
②饱和氨水溶液中c(OH-)约为1×10-3mol·L-1。
请回答下列问题:
(1)固体C为_________(填化学式)。
(2)上述流程中两次使用试剂X,试剂X是_________(填“氨水”或“氢氧化钠”),其理由是_________________。
(3)溶液D→固体E的过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是________________。
(4)写出溶液F→溶液H 的离子方程式:__________________。
(5)Ksp[Mg (OH )2]=_____________。