题目内容
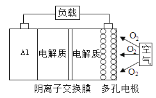
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:

(1)若开始时开关K与a连接,则B极的电极反应为____________________。
(2)若开始时开关K与b连接,则B极的电极反应为____________________,总反应的离子方程式为____________________。
(3)有关上述实验,下列说法正确的是______。
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
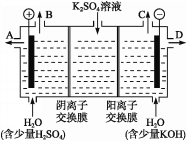
①该电解槽的阳极反应为______________。 此时通过阴离子交换膜的离子数_____(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)________导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因__________________________。
【答案】 Fe-2e- = Fe2+ 2H++2e- = H2↑ 2Cl-+2H2O![]() 2OH-+ H2↑+ Cl2↑ B 2H2O-4e- = 4H++ O2↑ 小于 D H2O
2OH-+ H2↑+ Cl2↑ B 2H2O-4e- = 4H++ O2↑ 小于 D H2O![]() H++ OH-,H+在阴极附近放电,引起水的电离平衡向右移动,使c(OH-)>c(H+)
H++ OH-,H+在阴极附近放电,引起水的电离平衡向右移动,使c(OH-)>c(H+)
【解析】试题分析:
(1) 开关K与a连接时,装置为原电池,铁为负极,发生吸氧腐蚀,即电极反应为Fe-2e-=Fe2+。
(2) 开关K与b连接时,装置为电解池,电解食盐水,此时阳极A发生2Cl--2e-=Cl2↑,阴极B发生2H++2e-H2↑,总反应的离子方程式为2Cl-+2H2O![]() 2OH-+ H2↑+ Cl2↑。
2OH-+ H2↑+ Cl2↑。
(3)阳离子向阴极移动,A错误;阳极A处产生的是Cl2,能使湿润的KI淀粉试纸变蓝,B正确;C应该通入HCl,不能加盐酸,因为盐酸是HCl的水溶液,错误;D电子不能在溶液中移动,错误。
(4))溶液中的OH-在阳极失电子产生O2:4OH--4e-=2H2O+O2↑,所以在B口放出O2,从A口导出H2SO4。溶液中的H+在阴极得到电子产生H2:2H++2e-=H2↑,则从C口放出H2,从D口导出KOH溶液。依据电荷守恒,通过阳离子交换膜的K+是通过阴离子交换膜的SO42-的2倍,所以通过阳离子交换膜的离子数大于通过阴离子交换膜的离子数。③电解过程中,H+在阴极附近放电,引起水的电离平衡向右移动,使c(OH-)>c(H+),故阴极区碱性明显增强。