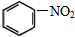题目内容
2. Ⅰ.甲硅烷(SiH4)常温下是一种无色气体,遇空气发生自燃.
Ⅰ.甲硅烷(SiH4)常温下是一种无色气体,遇空气发生自燃.(1)甲硅烷中含有的化学键是共价键,其在固态时属于分子晶体.
(2)室温下1g甲硅烷燃烧生成SiO2和H2O放热44.6kJ,其热化学方程式为SiH4(g)+2O2(g)═SiO2(s)+2H2O(l)△H=-1427.2kJ/mol.
Ⅱ.①CaCO3(s)═CaO(s)+CO2(g)△H=178.2kJ•mol-1
②2Na(s)+Cl2(g)═2NaCl(s)△H=-822.0kJ•mol-1
则:(3)上述反应①②中属于放热反应的是②(填序号).
(4)根据②计算生成1 mol NaCl(s)时,△H=-411.0kJ•mol-1kJ•mol-1
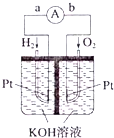
Ⅲ.氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图.该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
(5)氢氧燃料电池的能量转化形式主要是化学能转化为电能.在导线中电子流动方向为a→b(用a、b表示).
(6)负极反应式为2H2+4OH--4e-═4H2O;H2+2OH--2e-═2H2O.
(7)金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
2Li+H2═2LiH,LiH+H2O═LiOH+H2↑
则2mol锂储氢后释放出的H2可以消耗标准状态O2的体积是22.4L.
分析 Ⅰ、(1)根据甲硅烷的组成元素和物理性质判断;
(2)根据1g甲硅烷燃烧放出的热量计算1mol甲硅烷燃烧放出的热量,进而书写热化学方程式;
Ⅱ、(3)放热反应的焓变小于0,吸热反应的焓变大于0;
(4)生成2molNaCl放出822.0kJ热量,则生成1molNaCl放出其一半的热量;
Ⅲ、(5)原电池是将化学能转变为电能的装置;原电池放电时,电子从负极沿导线流向正极;
(6)负极上燃料失电子发生还原反应;
(7)据吸氢和放氢原理可知,2mol锂储氢后生成2molLiH,释放2mol氢气,2mol氢气能够消耗1mol氧气.
解答 解:Ⅰ、(1)SiH4由非金属形成的化合物,非金属元素之间的化学键为共价键,SiH4在常温下为气体,沸点较低,应为分子晶体,故答案为:共价键;分子;
(2)1g甲硅烷的物质的量为$\frac{1g}{32g/mol}$=$\frac{1}{32}$mol,放出44.6kJ的热量,
则1mol甲硅烷完全燃烧放出的热量为44.6kJ×32=1427.2kJ,
热化学方程式为SiH4(g)+2O2(g)═SiO2(s)+2H2O(l)△H=-1427.2 kJ/mol,
故答案为:SiH4(g)+2O2(g)═SiO2(s)+2H2O(l)△H=-1427.2 kJ/mol;
Ⅱ、(3)据热化学方程式,①CaCO3(s)═CaO(s)+CO2(g)△H=178.2kJ•mol-1
②2Na(s)+Cl2(g)═2NaCl(s)△H=-822.0kJ•mol-1可知①为吸热反应,②为放热反应,故答案为:②;
(4)生成2molNaCl放出822.0kJ热量,则生成1molNaCl放出其一半的热量,为411kJ热量,故答案为:△H=-411.0 kJ•mol-1;
Ⅲ、(5)该装置是把化学物质中的能力转化为电能,所以是化学能转变为电能;在原电池中,负极上失电子,正极上得电子,电子的流向是从负极流向正极,所以是 由a到b,故答案为:故答案为:化学能转化为电能;a→b;
(6)该反应中负极上氢气失电子生成氢离子而被氧化,所以电极反应式为H2+2OH--2e-═2H2O或2H2+4OH--4e-═4H2O,故答案为:2H2+4OH--4e-═4H2O;H2+2OH--2e-═2H2O;
(7)据吸氢和放氢原理可知,2mol锂储氢后生成2molLiH,释放2mol氢气,2mol氢气能够消耗1mol氧气,1mol氧气在标准状况下体积为22.4L,故答案为:22.4.
点评 本题考查了化学键类型和晶体类型、热化学方程式书写、焓变计算、氢氧燃料电池等等,考查范围广,但难度不大.

| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | 电解NaCl 溶液得到22.4L H2,理论上需要转移2NA个电子(NA阿伏伽德罗常数) | |
| C. | HCl 溶液和NaCl溶液均通过离子导电,所以HCl 和NaCl均是离子化合物 | |
| D. | 向沸水中逐滴加入少量饱和FeCl3 溶液,可制得Fe(OH)3胶体 |
| A. | 、 防治高血压 | B. |  防治缺铁性贫血 | ||
| C. |  做甜味剂 | D. | 、 火腿中加有防腐剂亚硝酸钠 |
| A. | 8个中子的碳原子的核符号:12C | B. | CH4分子的比例模型: | ||
| C. | Cl离子的结构示意图: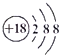 | D. | 氢氧化钠的电子式: |
| A. | CH3-CH2-CH2Br | B. | CH3-CHBr-CH2Br | C. | CH3-CH2-CHBr | D. | CH3-CHBr-CH3 |
| A. | 2SO2+O2?2SO3△H=-196.6kJ•mol-1 | |
| B. | C(g)+O2(g)=2CO△H=393.5kJ•mol-1 | |
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ | |
| D. | 2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 |
①SiC ②Si ③HCl ④HBr ⑤HI ⑥CO ⑦N2 ⑧H2.
| A. | ①②③④⑤⑥⑦⑧ | B. | ①②⑤④③⑥⑦⑧ | C. | ①②⑤④③⑦⑥⑧ | D. | ⑥⑤④③②①⑦⑧ |
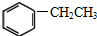 ④
④ ⑤CH3CH2CH=CH2 ⑥
⑤CH3CH2CH=CH2 ⑥