题目内容
11.为了综合利用副产品CaSO4,某化工厂与相邻的合成氨厂联合设计了下列(NH4)2SO4生产流程:请回答以下问题:(1)合成氨反应的化学方程式是N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,该反应在合成塔(填设备名)中发生,反应所用催化剂一般用铁触媒.
(2)沉淀池中发生的主要反应方程式是CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,该反应能够发生的原因是生成的CaCO3溶解度小于CaSO4有利于反应向正向进行.
(3)在上述流程中可以循环使用的物质是CO2,该生产过程中的副产品是生石灰.
(4)从绿色化学和资源综合利用的角度说明上述流程的主要优点是该流程中产生的CO2循环使用,得到的产品和副产品都是有用的物质,无废物产生.
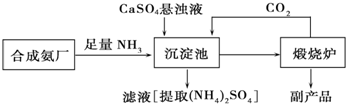
分析 工业合成氨的反应原理为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,将NH3和CO2通入沉淀池中并加入CaSO4,生成(NH4)2SO4和CaCO3,发生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,CaCO3在煅烧炉中分解生成CO2和CaO,CO2可循环使用,
(1)氮气和氢气在高温高压、催化剂条件下反应生成氨气,该反应在合成塔中进行,催化剂为铁触媒;
(2)CaCO3溶解度小于CaSO4,则沉淀池中硫酸钙与二氧化碳、氨气、水反应生成碳酸钙沉淀和硫酸铵;
(3)碳酸钙高温下分解生成氧化钙和二氧化碳,二氧化碳可以循环利用,氧化钙为副产品;
(4)从反应原理及可循环利用物质、副产品及是否有污染物生成等角度分析.
解答 解:(1)工业合成氨的反应原理为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;该反应在合成塔中进行,需要使用铁触媒做催化剂,
故答案为:N2+3H2 $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;合成塔;铁触媒;
(2)将NH3和CO2通入沉淀池中并加入CaSO4,由于生成的CaCO3溶解度小于CaSO4有利于反应向正向进行,则反应生成(NH4)2SO4和CaCO3,反应的化学方程式为:CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,
故答案为:CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4;生成的CaCO3溶解度小于CaSO4有利于反应向正向进行;
(3)CaCO3在煅烧炉中分解生成CO2和CaO,CO2可循环使用,副产品为生石灰,
故答案为:CO2;生石灰;
(4)根据反应流程离子,该反应的有点为:生成的CO2可循环使用,CaO可制备硫酸钙,没有废物生成,
故答案为:该流程中产生的CO2循环使用,得到的产品和副产品都是有用的物质,无废物产生.
点评 本题考查工业合成氨,题目难度中等,明确合成流程及反应原理为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力,(2)为易错点,需要从难溶物溶解平均及其转化实质角度考虑.

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案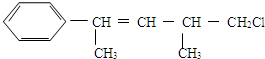
| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 能使溴水褪色 | |
| C. | 在加热和催化剂作用下,最多能和4 molH2反应 | |
| D. | 一定条件下,能发生取代反应 |
| A. | 原子序数:X>Y>Z>W | |
| B. | Y的气态氢化物的热稳定性比W的强 | |
| C. | 原子半径的大小顺序:r(Z)>r(Y)>r(W)>r(X) | |
| D. | X分别与Y、Z形成的化合物中化学键类型相同 |
| A. | 红外光谱分析 | B. | X-射线衍射实验 | C. | 质谱分析 | D. | 光谱分析 |
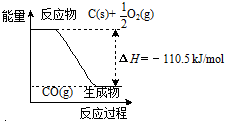
| A. | 12gC(s)与一定量O2(g)反应生成14g CO(g),放出的热量为110.5kJ | |
| B. | 该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 | |
| C. | 该反应的热化学方程式是2C(s)+O2(g)=2CO(g)△H=-221kJ | |
| D. | 2molC(s)与足量O2(g)反应生成CO2(g),放出的热量大于221kJ |
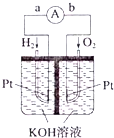 Ⅰ.甲硅烷(SiH4)常温下是一种无色气体,遇空气发生自燃.
Ⅰ.甲硅烷(SiH4)常温下是一种无色气体,遇空气发生自燃.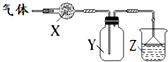 如图装置用于气体的干燥、收集和尾气吸收,其中X、Y、Z对应都正确的是( )
如图装置用于气体的干燥、收集和尾气吸收,其中X、Y、Z对应都正确的是( )