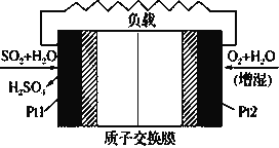
题目内容
【题目】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液的pH=_____________。
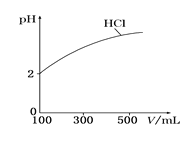
(2)体积均为100 mL、pH均为2的盐酸与一元弱酸HX,加水稀释过程中盐酸的pH与溶液体积的关系如图所示,则在图上画出HX加水至500mL稀释过程中pH值的变化曲线_____,并说明理由___________。
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
25 ℃时,在0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的_____倍。
(4)写出在NaCN溶液中通入少量CO2反应的离子方程式________________________。
(5)某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字实验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析合理的是___________。
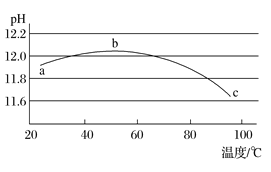
A 碳酸钠水解是吸热反应 B ab段说明水解平衡向右移动
C bc段说明水解平衡向左移动 D 水的电离平衡也对pH产生影响
【答案】11 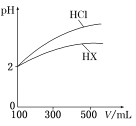 pH相同时HX的起始浓度大,稀释相同倍数,HX电离平衡右移,c(H+)变化量小,则HX的pH变化量比HCl的小 9×108 CN-+H2O+CO2=HCN+HCO3- ABD
pH相同时HX的起始浓度大,稀释相同倍数,HX电离平衡右移,c(H+)变化量小,则HX的pH变化量比HCl的小 9×108 CN-+H2O+CO2=HCN+HCO3- ABD
【解析】
(1)先计算100 ℃时的Kw,然后计算NaOH溶液的c(H+),再根据pH=-lgc(H+)计算。
(2)盐酸是强酸,在水中完全电离,HX是一元弱酸,在溶液中存在电离平衡,根据稀释对溶液中c(H+)的影响分析;
(3)先根据K计算溶液的c(H+),然后根据该温度下水的离子积常数计算溶液中c(OH-),酸溶液中水电离产生的c(H+)等于溶液中c(OH-);
(4)根据酸性H2CO3>HCN>HCO3-,结合CO2少量产生书写离子方程式;
(5) A.碳酸钠溶液中碳酸根离子水解,升温pH增大,说明水解是吸热反应;
B.ab段说明升温促进水解,碱性增大,溶液pH增大;
C.温度升高促进水解平衡正向进行。
D.随温度升高,此时促进盐类水解,对水的电离液起到促进作用,氢氧根离子浓度抑制水解平衡。
(1)纯水在100 ℃时,pH=6,则c(H+)=10-6mol/L,由于水电离产生的H+与OH-的物质的量浓度相等,所以该温度下Kw=c(H+)c(OH-)=10-12(mol/L)2;该温度下0.1 mol·L-1的NaOH溶液中,c(OH-)=0.1mol/L,所以c(H+)=10-11mol/L,因此该溶液的pH=11;
(2)开始时HCl、HX的pH=2,说明溶液中c(H+)相等,HCl是强酸,完全电离,c(HCl)=c(H+);HX是弱酸,部分电离,在溶液中存在电离平衡,所以c(HX)>c(H+);当把溶液稀释时,由于盐酸是强酸,完全电离,所以溶液中c(H+)减小,pH增大;而HX是弱酸,在溶液中存在电离平衡,稀释使溶液中c(H+)减小,平衡正向移动使c(H+)又有所增加,因此稀释相同倍数后,溶液中c(H+)大小相对来说HX溶液中大,则pH值HX小,盐酸大,故稀释与溶液的pH关系图为: ;
;
(3)CH3COOH在溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,K=
CH3COO-+H+,K=![]() ,所以c2(H+)=c (CH3COOH)K=0.5×1.8×10-5=9×10-6,所以c(H+)=3×10-3mol/L,由于Kw=10-14,所以c(OH-)=
,所以c2(H+)=c (CH3COOH)K=0.5×1.8×10-5=9×10-6,所以c(H+)=3×10-3mol/L,由于Kw=10-14,所以c(OH-)=![]() mol/L,由于水电离产生的H+与溶液中OH-浓度相等,所以水电离产生的c(H+)水=c(OH-)=
mol/L,由于水电离产生的H+与溶液中OH-浓度相等,所以水电离产生的c(H+)水=c(OH-)=![]() mol/L,所以0.5 mol/L的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的倍数是
mol/L,所以0.5 mol/L的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的倍数是![]() =9×108;
=9×108;
(4)根据酸性H2CO3>HCN,由于CO2少量,所以向NaCN溶液中通入少量CO2,发生反应产生HCN和NaHCO3,反应的离子方程式为CN-+H2O+CO2=HCN+HCO3-;
(5)A.分析图象,碳酸钠溶液中碳酸根离子水解,升温PH增大,说明水解是吸热反应,A正确;
B.ab段说明升温促进水解,氢氧根离子浓度增大,碱性增大溶液PH增大,图象符合,B正确;
C.温度升高促进水解平衡正向进行,C错误;
D.随温度升高,此时促进盐类水解,对水的电离液起到促进作用,氢氧根离子浓度抑制水解平衡,水的电离平衡也对pH产生影响,D正确;
故合理选项是ABD。

【题目】如何降低大气中CO2的含量及有效地开发利用CO2是当前科学家研究的重要课题。
(1)利用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 molH2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。
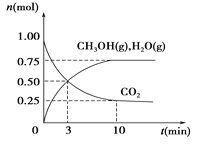
①从反应开始到3min时,氢气的平均反应速率v(H2)=_________。
②下列措施中一定能使CO2的转化率增大的是____________。
A.在原容器中再充入1 molCO2 B.在原容器中再充入1molH2
C.在原容器中充入1 molHe D.使用更有效的催化剂
E.缩小容器的容积 F.将水蒸气从体系中分离出
(2)利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH=akJ/mol,在一定条件下,测得该反应达到平衡状态时的实验数据如表所示。请根据表中数据回答下列问题。
CH3CH2OH(g)+3H2O(g) ΔH=akJ/mol,在一定条件下,测得该反应达到平衡状态时的实验数据如表所示。请根据表中数据回答下列问题。
温度(K) CO 2转化率/ (%)
| 500 | 600 | 700 | 800 |
1.5 | 45 | 33 | 20 | 12 |
2 | 60 | 43 | 28 | 15 |
3 | 80 | 61 | 35 | 21 |
①上述反应的a________0(填“大于”或“小于”)。该反应自发的条件是__________(填“高温”,“低温”,或“任意温度”)。
②恒温下,向反应体系中加入固体催化剂,则反应产生的热量________(填“增大”、“减小”或“不变”)。
③在2L密闭容器中充入1molCO2,在![]() =3,500K的温度下达到化学平衡时,则反应的平衡常数是_______________。
=3,500K的温度下达到化学平衡时,则反应的平衡常数是_______________。
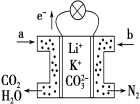
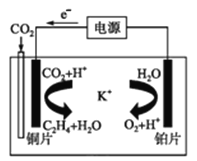
(3)锂空气电池是前景很广的新颖电池,但锂和空气中的氮气、二氧化碳、水蒸气等发生副反应是锂-空气电池的致命缺陷。所以应在锂金属电极上加一个保护层。该技术的核心是锂表面增加了一层由碳酸锂/碳(Li2CO3/C)组成的致密的保护性涂层。涂层的过程:利用熔融碳酸盐作电解质,直接由锂金属电极与二氧化碳通过 10 次充放电循环,在电极的表面进行化学反应来完成。写出锂电极生成致密保护涂层的电极反应式___________________。利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图所示。在阴极上产生乙烯的电极反应式为_________________。
【题目】利用下图所示装置进行下列实验,其中丙中实验现象描述正确的是( )
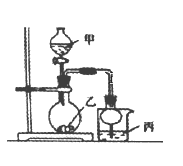
实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
A | 浓硫酸 | Na2SO3 | 紫色石蕊试液 | 溶液先变红后褪色 |
B | 浓盐酸 | KMnO4 | 淀粉—KI溶液 | 溶液变蓝 |
C | 稀盐酸 | CaCO3 | BaCl2溶液 | 有白色沉淀生成 |
D | 浓氨水 | CaO | AlCl3溶液 | 先生成白色沉淀然后沉淀溶解 |
A.AB.BC.CD.D