题目内容
【题目】甲醇是一种重要的可再生能源.
(1)利用二氧化碳合成甲醇来替代汽油。
已知:2CH3OH(l) +3O2(g)=4H2O(l)+2CO2(g) △H=—1453.0 kJ/mol,2H2(g) + O2(g)=2H2O(l) △H=—571.6 kJ/mol
计算CO2(g)+3H2(g) =CH3OH(l)+ H2O(l)的反应热△H=___________ kJ/mol。
(2)下图是反应CO(g)+2H2(g)![]() CH3OH(g)中CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线.从反应开始至达到平衡时,用H2表示的反应速率v(H2)=______________.
CH3OH(g)中CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线.从反应开始至达到平衡时,用H2表示的反应速率v(H2)=______________.
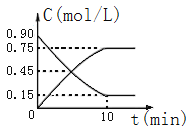
(3)在一恒容的密闭容器中充入1mol CO和2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g)△H并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如图所示.
CH3OH(g)△H并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如图所示.
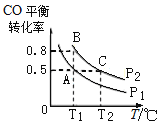
①能判断该反应达到化学平衡状态的是_____(填选项字母).
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等
D.混合气体的平均相对分子质量不再改变
②比较平衡常数KA、KB、KC的大小:____________
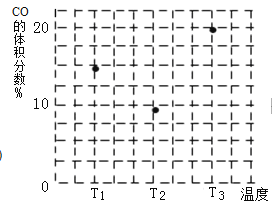
(4)在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是________(填“T1”或“T2” 或“T3”);
(5)电化学在我们的生产生活中占有越来越重要的地位。
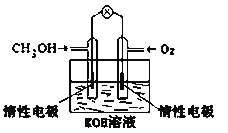
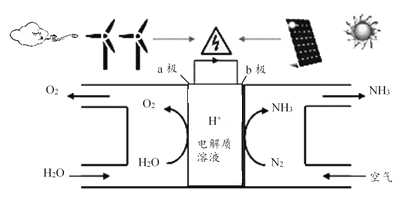
①燃料电池是一种绿色环保、高效的化学电源。图为甲醇燃料电池,则负极反应式为_____________。
②用甲醇燃料电池电解300mL饱和食盐水(惰性电极),则电解的离子方程式为____________________,电解一段时间后,当溶液的pH值为13时,消耗O2的质量为_______g。(忽略溶液体积变化)
【答案】-130.9 0.15mol/(L·min) BD KA=KB>KC T3 CH3OH – 6e-+ 8OH- = CO32- + 6H2O 2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑ 0.24
2OH-+Cl2↑+H2↑ 0.24
【解析】
(1)根据盖斯定律,由已知方程式构建目标方程式可得到CO2与H2反应生成CH3OH的热化学反应方程式;
(2)根据化学反应速率是υ(H2)=2υ(CH3OH)计算;
(3)①平衡标志是正逆反应速率相同,各成分浓度保持不变分析判断选项;
②平衡常数只与温度有关,A、B两点温度相同,平衡常数相同,由图可知,温度T1<T2,平衡时B点CO转化率更高,则降低温度平衡向正反应方向移动,K值增大;
(4)根据题中所给的图像进行分析;
(5)①分析元素化合价的变化可确定通入CH3OH的一极为负极,据此写出电极方程式;
②分析两个反应中的电子转移数目,结合甲醇燃料电池与电解池电子得失守恒找出关系式解答。
(1)已知:2CH3OH(l) +3O2(g)=4H2O(l)+2CO2(g) △H=-1453.0kJ/mol,2H2(g) + O2(g)=2H2O(l) △H=-571.6kJ/mol,根据盖斯定律,由②×3/2-①×1/2得:CO2(g)+3H2(g) =CH3OH(l)+ H2O(l) △H=(-571.6 kJ/mol )×3/2-(-1453.0kJ/mol) ×1/2=-130.9kJ/mol,故答案为:-130.9。
(2)υ(CH3OH)=△c/△t=0.75mol/L÷10min =0.075mol/(L·min),故υ(H2)=2υ(CH3OH)=0.15mol/(L·min),故答案为:0.15mol/(L·min)。
(3)①A.H2的消耗速率等于CH3OH的生成速率的2倍,都是指正反应方向,不能说明正逆反应速率相等,不一定平衡,故A错误;
B.H2的体积分数不再改变是化学平衡的特征,达到了平衡,故B正确;
C.体系中H2的转化率和CO的转化率相等,不能说明正逆反应速率相等,不一定平衡,故C错误;
D.混合气体的平均相对分子质量等于质量和物质的量的比值,物质的量变化,质量不变,所以当体系中气体的平均相对分子质量不再改变,证明达到了平衡,故D正确。
故答案为:BD。
②平衡常数只与温度有关,A、B两点温度相同,平衡常数相同,则KA=KB;由图可知,B、C两点压强相同,平衡时B点CO转化率更高,又温度T1<T2,则降低温度平衡向正反应方向移动,K值增大,则KB>KC,故答案为:KA=KB>KC。
(4)已知CO(g)+2H2(g)![]() CH3OH(g) △H<0,该反应正反应为放热反应,根据图中T1、T2、T3的图像,CO百分含量由小到大依次为:T3>T1>T2,T1中的状态转变为T2中的状态,CO的百分含量减小,说明平衡正向移动,说明T1为达到平衡状态,T2中的状态转变为T3中的状态,CO的百分含量增大,说明平衡逆向移动,说明T2可能达到平衡状态,一定达到平衡状态的是T3,故答案为:T3。
CH3OH(g) △H<0,该反应正反应为放热反应,根据图中T1、T2、T3的图像,CO百分含量由小到大依次为:T3>T1>T2,T1中的状态转变为T2中的状态,CO的百分含量减小,说明平衡正向移动,说明T1为达到平衡状态,T2中的状态转变为T3中的状态,CO的百分含量增大,说明平衡逆向移动,说明T2可能达到平衡状态,一定达到平衡状态的是T3,故答案为:T3。
(5)①图示为甲醇燃料电池,电解质为KOH溶液,CH3OH中碳元素的化合价由-2价升高到CO32-中的+4价,失去电子,所以通入CH3OH的一极是负极,负极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O。
②电解饱和食盐水是生成氢氧化钠、氢气和氯气,其离子方程式为:2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑,电解一段时间后,溶液的pH值为13,则溶液中的c(H+)=10-13mol/L,则电解生成的NaOH的物质的量浓度c(NaOH)=c(OH-)=Kw/c(H+)=10-14/10-13/span>=0.1mol/L,即生成NaOH的物质的量为0.1mol/L×0.3L=0.03mol,根据甲醇燃料电池与电解池电子得失守恒有:CH3OH~3/2O2~6e-~6NaOH,则消耗氧气的质量m(O2)=1/4n(NaOH)×M(O2)=1/4×0.03mol×32g/mol=0.24g,故答案为:0.24。
2OH-+Cl2↑+H2↑,电解一段时间后,溶液的pH值为13,则溶液中的c(H+)=10-13mol/L,则电解生成的NaOH的物质的量浓度c(NaOH)=c(OH-)=Kw/c(H+)=10-14/10-13/span>=0.1mol/L,即生成NaOH的物质的量为0.1mol/L×0.3L=0.03mol,根据甲醇燃料电池与电解池电子得失守恒有:CH3OH~3/2O2~6e-~6NaOH,则消耗氧气的质量m(O2)=1/4n(NaOH)×M(O2)=1/4×0.03mol×32g/mol=0.24g,故答案为:0.24。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案【题目】下列实验操作不能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 比较金属镁和铝的活泼性 | 分別向两只盛有等体积等浓度的稀硫酸烧杯中加入打磨过的同样大小的镁片和铝片,比较反应现象 |
B | 除去Mg粉中混有的Al 粉 | 加入足量的NaOH 溶液,过滤、洗涤、干燥 |
C | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
D | 配制0.4000mol·L1的NaOH溶液 | 称取4.0g固体NaOH于烧杯中,直接向烧杯中加入250mL水 |
A. AB. BC. CD. D
【题目】如何降低大气中CO2的含量及有效地开发利用CO2是当前科学家研究的重要课题。
(1)利用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 molH2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。
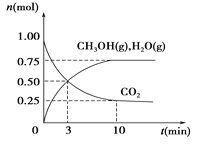
①从反应开始到3min时,氢气的平均反应速率v(H2)=_________。
②下列措施中一定能使CO2的转化率增大的是____________。
A.在原容器中再充入1 molCO2 B.在原容器中再充入1molH2
C.在原容器中充入1 molHe D.使用更有效的催化剂
E.缩小容器的容积 F.将水蒸气从体系中分离出
(2)利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH=akJ/mol,在一定条件下,测得该反应达到平衡状态时的实验数据如表所示。请根据表中数据回答下列问题。
CH3CH2OH(g)+3H2O(g) ΔH=akJ/mol,在一定条件下,测得该反应达到平衡状态时的实验数据如表所示。请根据表中数据回答下列问题。
温度(K) CO 2转化率/ (%)
| 500 | 600 | 700 | 800 |
1.5 | 45 | 33 | 20 | 12 |
2 | 60 | 43 | 28 | 15 |
3 | 80 | 61 | 35 | 21 |
①上述反应的a________0(填“大于”或“小于”)。该反应自发的条件是__________(填“高温”,“低温”,或“任意温度”)。
②恒温下,向反应体系中加入固体催化剂,则反应产生的热量________(填“增大”、“减小”或“不变”)。
③在2L密闭容器中充入1molCO2,在![]() =3,500K的温度下达到化学平衡时,则反应的平衡常数是_______________。
=3,500K的温度下达到化学平衡时,则反应的平衡常数是_______________。
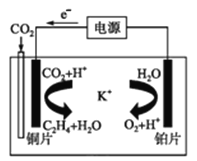
(3)锂空气电池是前景很广的新颖电池,但锂和空气中的氮气、二氧化碳、水蒸气等发生副反应是锂-空气电池的致命缺陷。所以应在锂金属电极上加一个保护层。该技术的核心是锂表面增加了一层由碳酸锂/碳(Li2CO3/C)组成的致密的保护性涂层。涂层的过程:利用熔融碳酸盐作电解质,直接由锂金属电极与二氧化碳通过 10 次充放电循环,在电极的表面进行化学反应来完成。写出锂电极生成致密保护涂层的电极反应式___________________。利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图所示。在阴极上产生乙烯的电极反应式为_________________。