��Ŀ����
����Ŀ����ѧ��Ӧ���ʺ���������������������ء�
(1)ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯����400mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼������ۼ�ֵ����
ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
���������mL������״���� | 100 | 240 | 464 | 576 | 620 |
����һʱ��η�Ӧ�������___min����0��1��1��2��2��3��3��4��4��5������Ӧ��ʼ��Ӧ�����������ԭ����__��
����3��4����ʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ����__________������Һ������䣩��
(2)��һѧ��Ϊ���Ʒ�Ӧ���ʷ�ֹ��Ӧ�������Բ�������������������������м���������������Һ�Լ�����Ӧ���ʣ�����Ϊ�����е���_��
A������ˮ B��KCl��Һ C��KNO3��Һ D��CuSO4��Һ
(3)ij�¶�����4L�ܱ������У�X��Y��Z������̬���ʵ����ʵ�����ʱ��仯������ͼ
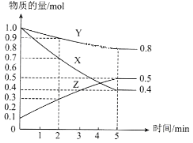
�ٸ÷�Ӧ�Ļ�ѧ����ʽ��__________��
�ڸ÷�Ӧ�ﵽƽ��״̬�ı�־��__________��
A��X��Y��Z�ķ�Ӧ������� B�������������ܶȱ��ֲ��� C������������ѹǿ���ֲ��� D������3molX��ͬʱ����1mol Y
��2min��X��ת����Ϊ__________��
���𰸡�2~3 ��Ϊ��Ӧ��ʼ���¶ȶԷ�Ӧ������������Ե����ã���Ӧ�Ƿ��ȷ�Ӧ,�����¶ȷ�Ӧ�������� 0.025mol/(L��min) CD 3X+Y2Z CD 30%
��������
(1)����ͬͨ�����£���Ӧ����Խ����ͬʱ�����ռ�������Խ�ࣻ�ɱ������ݿ�֪����Ӧ��������ʱ�����2��3 min����Ϊ��Ӧ��ʼ���¶ȶԷ�Ӧ������������Ե����ã���Ӧ�Ƿ��ȷ�Ӧ�������¶ȷ�Ӧ��������
��3��4����ʱ��Σ��ռ����������=(576-464)mL=112mL��n(H2)=![]() =0.005mol������������HCl��ϵʽ�����ĵ�n(HCl)=2n(H2)=2��0.005mol=0.01mol����v(HCl)=
=0.005mol������������HCl��ϵʽ�����ĵ�n(HCl)=2n(H2)=2��0.005mol=0.01mol����v(HCl)=![]() =0.025 mol/(Lmin)��
=0.025 mol/(Lmin)��
(2)A����������ˮ��������Ũ�ȼ�С����Ӧ���ʽ��ͣ���A��ѡ��
B������KCl��Һ��������Ũ�Ƚ��ͣ���Ӧ���ʽ��ͣ���B��ѡ��
C������KNO3��Һ���൱�ں������ᣬ�����Zn��Ӧ����NO��������������Cѡ��
D������CuSO4��Һ��Zn��ͭ���ӷ�Ӧ����Cu��Zn��Cu��ϡ���ṹ��ԭ��ض��ӿ췴Ӧ���ʣ���Dѡ��
(3)�ٸ���ͼ֪�����ŷ�Ӧ���У�X��Y�����ʵ������ٶ�Z�����ʵ������ӣ���X��Y�Ƿ�Ӧ���Z���������Ӧ�ﵽƽ��ʱ����n(X)=(1.0-0.4)mol=0.6mol����n(Y)=(1.0-0.8)mol=0.2mol����n(Z)=(0.5-0.1)mol=0.4mol��ͬһ���淴Ӧ��ͬһ��ʱ���ڲμӷ�Ӧ�ĸ����ʵ����ʵ����仯��֮�ȵ��������֮�ȣ�X��Y��Z�ļ�����֮��=0.6mol��0.2mol��0.4mol=3��1��2����÷�Ӧ����ʽΪ3X+Y2Z��
��A������֮�ȵ��ڼ�����֮�ȣ�X��Y��Z���߷�Ӧ���ʲ�������ȣ���A����
B����Ӧ����������Ϊ���壬���Է�Ӧ��������������������䣬�����ݻ��㶨������������ܶ�ʼ�ղ��䣬��B����
C���÷�Ӧǰ������ϵ��֮�Ͳ���ȣ�����δƽ��ʱ����������ʵ�����䣬�����ݻ��㶨������ѹǿ��䣬������������ѹǿ���ֲ���ʱ����Ӧ�ﵽƽ��״̬����C��ȷ��
D������3molX��ͬʱ������1molY��ͬʱ������1mol Y�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬����D��ȷ��
��ѡ��CD��
��2min��Xת��1.0mol-0.7mol=0.3mol����X��ת����Ϊ![]() ��100%=30%��
��100%=30%��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ������ʵ��������ܴﵽʵ��Ŀ�ĵ���
ѡ�� | ʵ��Ŀ�� | ʵ����� |
A | �ȽϽ���þ�����Ļ����� | �քe����ֻʢ�е������Ũ�ȵ�ϡ�����ձ��м����ĥ����ͬ����С��þƬ����Ƭ���ȽϷ�Ӧ���� |
B | ��ȥMg���л��е�Al �� | ����������NaOH ��Һ�����ˡ�ϴ�ӡ����� |
C | ̽��ά����C�Ļ�ԭ�� | ��ʢ��2 mL��ɫ�Ȼ�����Һ���Թ��еμ�Ũ��ά����C��Һ���۲���ɫ�仯 |
D | ����0.4000mol��L1��NaOH��Һ | ��ȡ4.0g����NaOH���ձ��У�ֱ�����ձ��м���250mLˮ |
A. AB. BC. CD. D