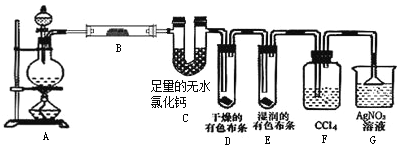
题目内容
【题目】氯气有毒,化工厂常用浓氨水检验管道是否漏氯气。如氯气泄漏,会在管道周围产生大量白烟,反应的化学方程式为:3Cl2+8NH3=6NH4Cl+N2
(1)用双线桥法分析上述反应(只需标出电子转移的方向和数目)________。
(2)上述反应中,氧化剂的化学式是________,发生了________反应(填写“氧化”或“还原”)。
(3)上述反应中,氧化剂与还原剂的物质的量之比是________。
(4)若反应中转移了1.2 mol电子,产生的气体在标准状况下的体积为________。
【答案】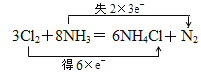 Cl2 还原 3:2 4.48 L
Cl2 还原 3:2 4.48 L
【解析】
在氧化还原反应中,化合价升高的元素,失电子,被氧化,所对应的反应物为还原剂,化合价降低的元素,得电子,被还原,所对应的反应物为氧化剂。在3Cl2 + 8NH3 = 6NH4Cl + N2反应中,N元素化合价由-3价升高到0价,Cl元素由0价降低到-1价,电子转移总数为6e-,以此来作答。
(1)在3Cl2 + 8NH3 = 6NH4Cl + N2反应中,N元素化合价由-3价升高到0价,Cl元素由0价降低到-1价,电子转移总数为6e,电子得失的方向和数目用双线桥表示为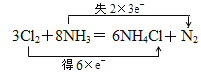 ,
,
故答案为: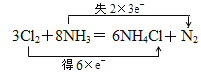 ;
;
(2)Cl元素化合价降低,被还原,发生还原反应,则Cl2为氧化剂,
故答案为:Cl2;还原;
(3)3 mol Cl2参与反应,元素化合价由0价降低到-1价,作氧化剂;N元素失去电子被氧化,则N2为氧化产物,由反应可知,8 mol NH3反应只有2 mol N化合价由-3价升高到0价得到1 mol N2,则作还原剂的NH3只有2 mol,因此氧化剂与还原剂的物质的量之比为3:2,故答案为:3:2;
(4)根据双线桥得出,6 e![]() 1 N2,则当反应中转移了1.2 mol电子,产生的N2在标准状况下的体积是V =
1 N2,则当反应中转移了1.2 mol电子,产生的N2在标准状况下的体积是V = ![]() = 4.48 L,故答案为:4.48 L。
= 4.48 L,故答案为:4.48 L。