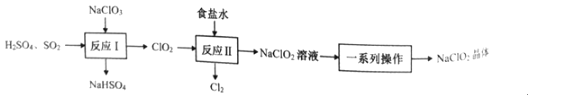
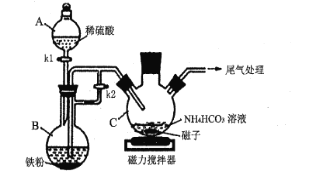
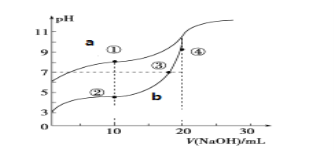
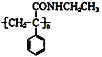
题目内容
【题目】下列反应物按所给物质的量配比进行反应,其中固体完全反应的是( )
A.n(Cu):n(HNO3浓)=1:4B.n(Fe):n(HNO3浓)=1:2
C.n(C):n(H2SO4浓)=1:2D.n(MnO2):n(HCl浓)=1:4
【答案】A
【解析】
A.铜与浓硝酸开始发生反应Cu+ 4HNO(浓) =Cu(NO)+ 2NO2↑ + 2HO,硝酸变稀后发生反应3Cu+ 8HNO(稀) =3Cu(NO)+ 2NO↑ + 4HO,n(Cu):n(HNO3浓)=1:4,铜能完全反应,故选A;
B.n(Fe):n(HNO3浓)=1:2,若铁完全溶解生成Fe (NO),表现酸性的硝酸为铁的2倍,则缺少表现氧化性的硝酸,所以硝酸不足,铁不能完全反应,故不选B;
C.n(C):n(H2SO4浓)=1:2,碳和浓硫酸反应的方程式是C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,变为稀硫酸后就不再反应,碳不能完全反应,故不选C;
CO2↑+2SO2↑+2H2O,变为稀硫酸后就不再反应,碳不能完全反应,故不选C;
D.n(MnO2):n(HCl浓)=1:4,MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,盐酸变稀后就不再反应,MnO2不能完全反应,故不选D;
MnCl2+Cl2↑+2H2O,盐酸变稀后就不再反应,MnO2不能完全反应,故不选D;

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目