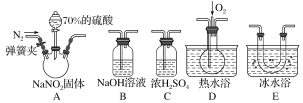
题目内容
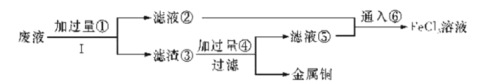
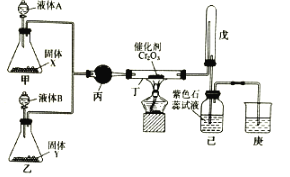
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等。已知:饱和NaClO2溶液在温度低于38℃时析出NaCO23H2O晶体,温度高于38℃时析出NaClO2晶体,温度高于60℃时,NaClO2分解生成NaClO3和NaCl。其生产工艺如图所示。
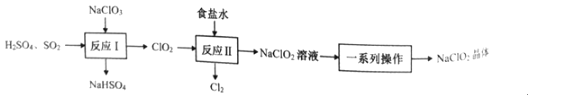
回答下列问题:
(1)NaClO2中氯元素的化合价为__。
(2)“反应Ⅰ”中氧化剂与还原剂的物质的量之比为__。
(3)“反应”所用“食盐水”由粗盐水精制而成。精制时,为除去粗盐水中的Ca2+、Mg2+和SO42-,需要用到试剂:①NaOH溶液②Na2CO3溶液③BaCl2溶液④稀盐酸,所用试剂的加入顺序正确的是__。(填标号)
A.①②③④
B.②①③④
C.③①②④
D.③②①④
(4)“一系列操作”为蒸发浓缩、趁热过滤、__、干燥,其中“趁热过滤”应控制的温度范围是__。
(5)“反应Ⅱ”产生的Cl2可用于制备含氯消毒剂。将Cl2通入足量NaOH溶液中,加热后得到NaCl、NaCIO、NaClO3的混合液。经测定ClO-与ClO3-的物质的量浓度之比为3:1,则Cl2与NaOH溶液反应时,被氧化的氯元素与被还原的氯元素的物质的量之比为__。
【答案】+3 2:1 C 洗涤 大于38℃小于60℃ 1:2
【解析】
(1)根据化合价代数和等于0计算NaClO2中氯元素的化合价;
(2)“反应Ⅰ”是氯酸钠、二氧化硫、硫酸反应生成硫酸氢钠、二氧化氯;
(3)食盐精制时,加NaOH溶液除去Mg2+;加 Na2CO3溶液除去Ca2+、Ba2+;加BaCl2溶液除去SO42-;过滤后加稀盐酸除去CO32-、OH-;
(4)晶体需要洗涤后干燥;温度高于38℃时析出NaClO2晶体,温度高于60℃时,NaClO2分解生成NaClO3和NaCl;
(5)根据得失电子守恒计算被氧化的氯元素与被还原的氯元素的物质的量之比;
(1)NaClO2中钠元素化合价为+1、氧元素化合价为-2,根据化合价代数和等于0,氯元素的化合价为+3;
(2)“反应Ⅰ”是氯酸钠、二氧化硫、硫酸反应生成硫酸氢钠、二氧化氯,根据得失电子守恒配平方程式为2NaClO3+SO2+H2SO4= 2NaHSO4+2ClO2,硫元素化合价升高,SO2是还原剂,氯元素化合价降低,NaClO3是氧化剂,氧化剂与还原剂的物质的量之比为2:1;
(3)精制食盐时,加NaOH溶液除去Mg2+;加 Na2CO3溶液除去Ca2+、Ba2+;加BaCl2溶液除去SO42-;过滤后加稀盐酸除去CO32-、OH-;所以加入氯化钡后再加碳酸钠,加试剂的顺序是③①②④,故选C。
(4)“一系列操作”为蒸发浓缩、趁热过滤、洗涤、干燥;温度高于38℃时析出NaClO2晶体,温度高于60℃时,NaClO2分解生成NaClO3和NaCl,所以“趁热过滤”应控制的温度范围是大于38℃小于60℃;
(5)Cl2通入足量NaOH溶液中,加热后得到NaCl、NaCIO、NaClO3的物质的量比为x:3:1,根据得失电子守恒,x×(-1)+3×1+1×5=0,解得x=8,被氧化的氯元素与被还原的氯元素的物质的量之比1:2。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案