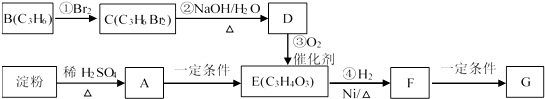
题目内容
【题目】下列说法中不正确的是( )
A.电负性的大小顺序为Cl>S>P
B.由于NO3﹣和SO3互为等电子体,所以可以推断NO3﹣的空间构型为平面三角形
C.根据晶格能的大小可以判断MgCl2的熔点比CaCl2高
D.液态HF的沸点比液态HCl的沸点高是因为氢氟键的键能比氢氯键的键能大
【答案】D
【解析】解:A.同一周期元素,元素的电负性随着原子序数的增大而增大,这三种元素的电负性大小顺序是Cl>S>P,故A正确; B.等电子体原子个数相等、价电子数相等,且结构相似,NO3﹣和SO3互为等电子体,NO3﹣的价层电子对个数=3+ ![]() ×(5+1﹣3×2)=3,则该微粒是平面三角形结构,故B正确;
×(5+1﹣3×2)=3,则该微粒是平面三角形结构,故B正确;
C.离子晶体中,晶格能大小与离子半径成反比、与电荷成正比,氯化镁和氯化钙中阴离子相同,阳离子不同,镁离子半径小于钙离子,所以氯化镁的晶格能大于氯化钙,则氯化镁的熔点高于氯化钙,故C正确;
D.HF中存在氢键、HCl中不存在氢键,氢键的存在导致HF的沸点高于HCl,故D错误;
故选D.
【考点精析】本题主要考查了氢键的存在对物质性质的影响的相关知识点,需要掌握氢键主要存在于HF、H2O、NH3、CH3CH2OH分子间;故HF、H2O、NH3的沸点分别与同族氢化物沸点相比反常的高才能正确解答此题.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目