题目内容
【题目】原电池是将化学能转化为电能的装置。
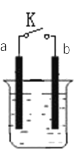
I. a为铜片,b为铁片,烧杯中是稀硫酸溶液
(1)当开关K断开时产生的现象为_______ ;当开关K闭合时,产生的现象为_________。
A.a不断溶解 B.b不断溶解 C.a上产生气泡 D.b上产生气泡 E.溶液逐渐变蓝
(2)闭合开关K,反应一段时间后断开开关K,经过一段时间后,下列叙述不正确的是___________ 。
A.溶液中H+浓度减小 B.正极附近![]() 浓度逐渐增大
浓度逐渐增大
C.溶液中含有FeSO4 D.溶液中![]() 浓度基本不变
浓度基本不变
II.FeCl3常用于腐蚀印刷电路铜板,反应过程的离子方程式为 ________ ,若将此反应设计成原电池,请写出该原电池负极电极反应为_______,正极电极反应为______。
III.如图是氢氧燃料电池构造示意图。
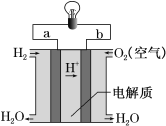
下列说法不正确的是______
A.a极是负极
B.电子由b通过溶液流向a
C.该电池总反应是2H2+O2=2H2O
D.氢氧燃料电池是环保电池
【答案】BD BC B 2Fe3+ + Cu = 2Fe2+ + Cu2+ Cu - 2e-= Cu2+ 2Fe3+ + 2e-= 2Fe2+ B
【解析】
在一般的原电池中,通常情况下,相对活泼的电极作负极,相对不活泼的电极作正极,电子由负极沿导线流入正极,在电解质溶液中,阳离子向正极移动,阴离子向负极移动;在燃料电池中,通燃料的电极为负极,通空气或氧气的电极为正极。
I. a为铜片,b为铁片,烧杯中是稀硫酸溶液
(1)当开关K断开时,铜片与稀硫酸不反应,没有现象产生,铁片与稀硫酸反应:Fe+H2SO4=FeSO4+H2↑,产生的现象为铁片不断溶解、b上有气泡逸出,故选BD;当开关K闭合时,形成原电池,铁片作负极,铜片作正极,产生的现象为铁片不断溶解、铜片上有气泡逸出,故选BC。答案为:BD;BC;
(2)闭合开关K,反应一段时间后断开开关K,闭合开关K时,在溶液中:负极Fe-2e- =Fe2+,正极2H++2e-=H2↑,断开开关K后,Fe与H+发生置换反应生成Fe2+和氢气,所以溶液中H+浓度减小、Fe2+浓度增大、但![]() 浓度基本不变,阳离子Fe2+向正极移动,阴离子
浓度基本不变,阳离子Fe2+向正极移动,阴离子![]() 向负极移动,溶液中含有FeSO4,故选B。答案为:B;
向负极移动,溶液中含有FeSO4,故选B。答案为:B;
II.FeCl3腐蚀印刷电路铜板时,将Cu氧化为CuCl2,自身被还原为FeCl2,反应过程的离子方程式为2Fe3++ Cu = 2Fe2++ Cu2+,若将此反应设计成原电池,则该原电池负极为Cu,电极反应为Cu - 2e-= Cu2+,正极为碳等,电极反应为2Fe3++ 2e-= 2Fe2+。答案为:2Fe3++ Cu = 2Fe2++ Cu2+;Cu - 2e-= Cu2+;2Fe3++ 2e-= 2Fe2+;
III.从氢氧燃料电池构造示意图中可以看出,a电极为负极,b电极为正极,电子从负极a沿导线流向正极b,电极反应式为:负极H2-2e-=2H+,正极O2+4e-+4H+=2H2O,总反应式为2H2+O2=2H2O,产物不污染环境,所以电池为环保电池,故选B。答案为:B。