题目内容
【题目】按要求作答
(1)钴位于元素周期表的第__族,其基态原子中未成对电子个数为__。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为__,所含非金属元素的电负性由大到小的顺序是__。
(3)尿素[CO(NH2)2]分子中σ键与π键的数目之比为__。
(4)硒、硅均能与氢气化合形成气态氢化物,若“Si-H”中共用电子对偏向氢,氢气与硒反应时,硒单质做氧化剂,则硒与硅的电负性大小为Se__Si(填“>”或“<”)
(5)与Si同周期部分元素的逐级电离能如图所示,其中a、b和c分别代表__。

A.a为I1、b为I2、c为I3 B.a为I2、b为I3、c为I1
C.a为I3、b为I2、c为I1 D.a为I1、b为I3、c为I2
【答案】VIII 3 [Ar]3d5或1s22s22p63s23p63d5 O>N>C>H 7:1 > B
【解析】
(1)钴为27号元素,位于第四周期VIII族,其价电子排布式为3d74s2;
(2)Fe的价电子排布式为3d64s2,则Fe3+的核外电子排布式为[Ar]3d5;所含非金属元素为H、C、N、O;
(3)尿素[CO(NH2)2]的结构简式为![]() ;
;
(4)“Si-H”中共用电子对偏向氢,则Si为正价,氢气与硒反应时,硒单质做氧化剂,则硒化合价降低,为负价,则硒的电负性大于硅的;
(5)图像a,Na的电离能最大,此时的含Na元素的微粒处于稳定结构,则为第二电离能;图像b中含Mg微粒的电离能最大,则含Mg微粒处于稳定结构,为第三电离能;图像c与第一电离能相同,则为第一电离能。
(1)钴为27号元素,位于第四周期VIII族,其价电子排布式为3d74s2,未成对电子个数为3;
(2)Fe的价电子排布式为3d64s2,则Fe3+的核外电子排布式为[Ar]3d5或1s22s22p63s23p63d5;所含非金属元素为H、C、N、O,电负性由大到小的顺序是O>N>C>H;
(3)尿素[CO(NH2)2]的结构简式为![]() ,含有7条σ键,1条π键,比值为7:1;
,含有7条σ键,1条π键,比值为7:1;
(4)“Si-H”中共用电子对偏向氢,则Si为正价,氢气与硒反应时,硒单质做氧化剂,则硒化合价降低,为负价,则硒的电负性大于硅的;
(5)图像a,Na的电离能最大,此时的含Na元素的微粒处于稳定结构,则为第二电离能;图像b中含Mg微粒的电离能最大,则含Mg微粒处于稳定结构,为第三电离能;图像c与第一电离能相同,则为第一电离能,答案为B。

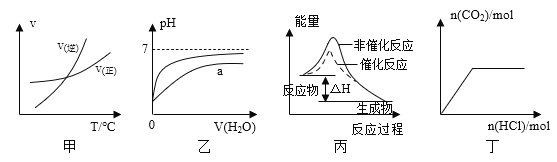
【题目】(I)![]() 和
和 的一些物理性质如下表:
的一些物理性质如下表:
物质 | 熔点 | 沸点 | 密度 | 水溶性 |
| -10℃ | 212℃ | 1.1622g/mL | 不溶于水 |
| 54℃ | 238℃ | 1.1581g/mL | 不溶于水 |
①分离这两种物质混合物可采用的方法是__。(填序号)
A.过滤 B.分液 C.蒸发 D.分馏
②实验需要用到的主要玻璃仪器是___。
(II)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有___、___等。
(2)若用如图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为___、___。
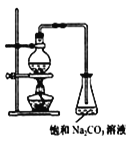
(3)此反应以浓硫酸为催化剂,可能会造成___、__问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)
同一反应时间 | 同一反应温度 | ||||
反应温度/℃ | 转化率(%) | 选择性(%) | 反应时间/h | 转化率(%) | 选择性(%) |
40 | 77.8 | 100 | 2 | 80.2 | 100 |
60 | 92.3 | 100 | 3 | 87.8 | 100 |
80 | 92.6 | 100 | 4 | 92.3 | 100 |
120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
根据表中数据,下列___(填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h
C.60℃,4h D.40℃,3h