题目内容
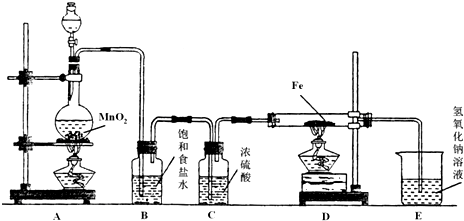
某研究性学习小组设计实验,用于制取SO2并探究SO2的某些性质.制取SO2反应的化学方程式为:Na2SO3+2H2SO4=Na2SO4+SO2↑+H2O,产生的气体通入如图所示装置: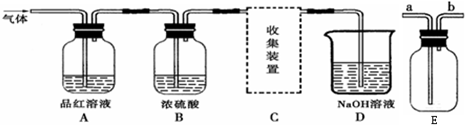
【实验探究】
(1)将12.6g的Na2SO3与足量的浓硫酸反应可制得SO2的体积为
(2)A装置观察到的现象是
(3)B装置中浓硫酸的作用是
(4)D装置的作用是
【实验讨论】
对上图中的C处,甲乙两同学都选用图E装置,但对连接方式持有不同意见.
甲同学认为:SO2气体应从a处通入集气瓶中.
乙同学认为:SO2气体应从b处通入集气瓶中.
你认为
(已知:同等条件下二氧化硫的密度大于空气)
【联系实际】
SO2对环境的影响较大,为了减少SO2对空气的污染,请你提出一种有效的措施.
分析:【实验探究】
(1)由质量求出的Na2SO3物质的量,二氧化硫的物质的量与Na2SO3物质的量相等,带入n=
求算体积,反应前后化合价发生变化的反应属于氧化还原反应;
(2)二氧化硫可使品红溶液褪色,表现了二氧化硫的漂白性;
(3)浓硫酸的作用是干燥二氧化硫气体,浓硫酸不能氧化二氧化硫气体;
(4)二氧化硫气体污染大气,装置D作为尾气吸收之用;
【实验讨论】二氧化硫气体密度比空气的大,应用向上排空气法收集;
【联系实际】减少SO2对空气的污染可从产生源头、产生后吸收等方面采取措施.
(1)由质量求出的Na2SO3物质的量,二氧化硫的物质的量与Na2SO3物质的量相等,带入n=
| V |
| Vm |
(2)二氧化硫可使品红溶液褪色,表现了二氧化硫的漂白性;
(3)浓硫酸的作用是干燥二氧化硫气体,浓硫酸不能氧化二氧化硫气体;
(4)二氧化硫气体污染大气,装置D作为尾气吸收之用;
【实验讨论】二氧化硫气体密度比空气的大,应用向上排空气法收集;
【联系实际】减少SO2对空气的污染可从产生源头、产生后吸收等方面采取措施.
解答:解:【实验探究】
(1)n(Na2SO3)=
=0.1mol,根据化学方程式可知,二氧化硫的物质的量与Na2SO3物质的量相等,生成标准状况下的二氧化硫的体积V=0.1mol×22.4L/mol=2.24L;
在Na2SO3+2H2SO4=Na2SO4+SO2↑+H2O中S的化合价没有发生变化,因此该反应不属于氧化还原反应,
故答案为:2.24;不是;
(2)二氧化硫可使品红溶液褪色,表现了二氧化硫的漂白性,故答案为:品红溶液褪色;漂白性;
(3)浓硫酸不能氧化二氧化硫气体,浓硫酸的作用除掉二氧化硫气体中混有的水蒸气,故答案为:干燥剂;
(4)二氧化硫气体污染大气,二氧化硫能与氢氧化钠溶液反应而被吸收,因此装置D作为尾气吸收之用,
故答案为:吸收多余的SO2,防止污染空气;
【实验讨论】二氧化硫气体密度比空气的大,应用向上排空气法收集,应该从a进入集气瓶,故甲同学正确,
故答案为:甲;
【联系实际】减少SO2对空气的污染可从产生源头、产生后吸收等方面采取措施.
例如①减少化石燃料的使用
②对SO2的排放加以控制
③改变能源结构,开发利用清洁能源
④工业上对煤进行脱硫处理
⑤对SO2气体进行处理或回收利用
故答案为①减少化石燃料的使用
②对SO2的排放加以控制
③改变能源结构,开发利用清洁能源
④工业上对煤进行脱硫处理
⑤对SO2气体进行处理或回收利用
(以上任选其一或其他合理答案均可).
(1)n(Na2SO3)=
| 12.6g |
| 126g?mol-1 |
在Na2SO3+2H2SO4=Na2SO4+SO2↑+H2O中S的化合价没有发生变化,因此该反应不属于氧化还原反应,
故答案为:2.24;不是;
(2)二氧化硫可使品红溶液褪色,表现了二氧化硫的漂白性,故答案为:品红溶液褪色;漂白性;
(3)浓硫酸不能氧化二氧化硫气体,浓硫酸的作用除掉二氧化硫气体中混有的水蒸气,故答案为:干燥剂;
(4)二氧化硫气体污染大气,二氧化硫能与氢氧化钠溶液反应而被吸收,因此装置D作为尾气吸收之用,
故答案为:吸收多余的SO2,防止污染空气;
【实验讨论】二氧化硫气体密度比空气的大,应用向上排空气法收集,应该从a进入集气瓶,故甲同学正确,
故答案为:甲;
【联系实际】减少SO2对空气的污染可从产生源头、产生后吸收等方面采取措施.
例如①减少化石燃料的使用
②对SO2的排放加以控制
③改变能源结构,开发利用清洁能源
④工业上对煤进行脱硫处理
⑤对SO2气体进行处理或回收利用
故答案为①减少化石燃料的使用
②对SO2的排放加以控制
③改变能源结构,开发利用清洁能源
④工业上对煤进行脱硫处理
⑤对SO2气体进行处理或回收利用
(以上任选其一或其他合理答案均可).
点评:本题考查了SO2的性质的实验设计和性质分析判断,掌握二氧化硫酸性氧化物性质、漂白性、还原性等是解题关键,【联系实际】中答案开放性强,题目难度中等.

练习册系列答案
相关题目