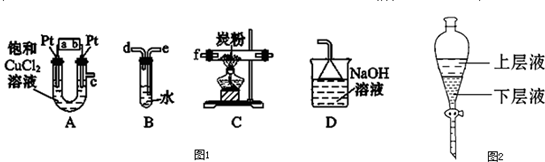
题目内容
某研究性学习小组设计如图装置制取氯气并以氯气为原料制备FeCl3固体.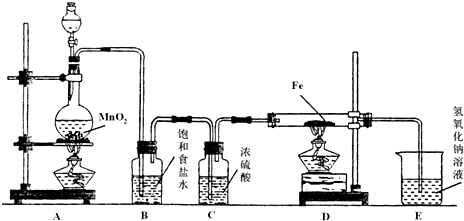
(1)连接好装置后,在加入药品前应进行的实验操作是
(2)装置A烧瓶中发生反应的离子方程式为
(3)实验时,应先点燃
分析:(1)药品加入装置前,需先检验装置的气密性;
(2)实验室用浓盐酸与二氧化锰加热制取氯气;氯气在饱和食盐水中溶解度小,可以降低氯气的溶解度,同时除去氯化氢杂质;
(3)实验时,应先点燃A,产生氯气排出空气,氯气和铁反应生成棕红(棕褐)色的氯化铁,氯气是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收,生成氯化钠、次氯酸钠和水.
(2)实验室用浓盐酸与二氧化锰加热制取氯气;氯气在饱和食盐水中溶解度小,可以降低氯气的溶解度,同时除去氯化氢杂质;
(3)实验时,应先点燃A,产生氯气排出空气,氯气和铁反应生成棕红(棕褐)色的氯化铁,氯气是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收,生成氯化钠、次氯酸钠和水.
解答:解:(1)根据实验目的须制氯气,所以连接仪器后,应先检查装置的气密性,
故答案为:检验装置的气密性;
(2)实验室制备氯气是利用二氧化锰和浓盐酸加热反应生成二氯化锰、氯气和水,反应的化学方程式为:4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O,二氧化锰、氯气、水在离子反应中须写化学式,所以离子反应为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O?H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,除去挥发出的HCl气体,抑制C12在水中的溶解,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;除去Cl2中的HCl;
(3)实验时,应先点燃A,产生氯气排出空气,氯气和铁反应生成棕红(棕褐)色的氯化铁,氯气有毒不能排放到空气中污染环境,用氢氧化钠溶液吸收生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,氯化钠、次氯酸钠为易溶于水易电离的盐,所以离子反应为:Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:A;剧烈反应,产生棕红(棕褐)色的烟;Cl2+2OH-=Cl-+ClO-+H2O.
故答案为:检验装置的气密性;
(2)实验室制备氯气是利用二氧化锰和浓盐酸加热反应生成二氯化锰、氯气和水,反应的化学方程式为:4HCl(浓)+MnO2
| ||
| ||
故答案为:MnO2+4H++2Cl-
| ||
(3)实验时,应先点燃A,产生氯气排出空气,氯气和铁反应生成棕红(棕褐)色的氯化铁,氯气有毒不能排放到空气中污染环境,用氢氧化钠溶液吸收生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,氯化钠、次氯酸钠为易溶于水易电离的盐,所以离子反应为:Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:A;剧烈反应,产生棕红(棕褐)色的烟;Cl2+2OH-=Cl-+ClO-+H2O.
点评:本题考查氯气的制取方法、氯气性质、实验除杂的方法选择和尾气的处理等知识,注意氯气的化学性质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目