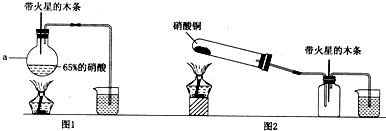
��Ŀ����
��ͼ��ij�о���ѧϰС����ƵĶ�һ�ַϾɺϽ�ĸ��ɷ֣�����Cu��Fe��Si ���ֳɷ֣����з��롢���������õĹ�ҵ���̣�ͨ�������̽����ɷ�ת��Ϊ���õĵ��ʼ������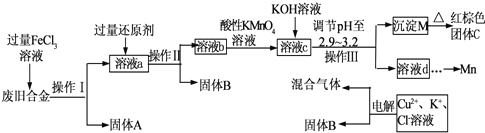
��֪��298Kʱ��Ksp[Cu��OH��2]=2.2��10-20��Ksp[Fe��OH��3]=4.0��10-38��Ksp[Mn��OH��2]=1.9��10-13�������������̻ش��й����⣺
��1��������ָ����
��2���������FeCl3��Һ�����п����漰�Ļ�ѧ����ʽ��
��3�������Ļ�ԭ��Ӧ��
��4��������Һb�м�������KMnO4��Һ������Ӧ�����ӷ���ʽΪ
������X mol/L KMnO4��Һ������Һb����ǡ�ý���Һ�е���������ȫ����ʱ����KMnO4��ҺY mL����������ú���ɫ����C������Ϊ
��5�������£�����Һc�������Ľ���������Ũ����ȣ�����Һc����μ���KOH��Һ�������ֽ��������ӳ������Ⱥ�˳��Ϊ��
��6�����һ��������ö��Ե缫���һ��ʱ�����������B������ΪZ g��ͬʱ������������ռ��������������ȣ��������������ɵ����һ���������Ϊ
��������1�����ݲ��������õ����������жϣ�
��2��FeCl3���������ԣ��������ͭ������
��3���������������Һ�к�ͭ����������Ļ�ԭ��Ŀ���ǻ�ԭ�������Ȼ�����
��4������Һb�к��������ӣ��ᱻ���Ը������������
�ڸ��ݹ�ϵʽ��ԭ���غ�ɼ����C��Fe2O3����������
��5�������ܶȻ�������С�жϳ����Ⱥ�˳��
��6�������̿�֪������Ȼ�ͭ�õ�ͭ������������Zg ͭת�Ƶ�����Ϊ��
��2������������
mol��Ҫʹ�����õ����������ͬ����Ҫ���ˮ������ˮ�����ʵ���Ϊx�����ݷ�Ӧʽ��2H2O
H2��+O2����֪������xmol������0.5xmol�����������������������ȿ��г����̣�д�������缫��Ӧʽ��
��2��FeCl3���������ԣ��������ͭ������
��3���������������Һ�к�ͭ����������Ļ�ԭ��Ŀ���ǻ�ԭ�������Ȼ�����
��4������Һb�к��������ӣ��ᱻ���Ը������������
�ڸ��ݹ�ϵʽ��ԭ���غ�ɼ����C��Fe2O3����������
��5�������ܶȻ�������С�жϳ����Ⱥ�˳��
��6�������̿�֪������Ȼ�ͭ�õ�ͭ������������Zg ͭת�Ƶ�����Ϊ��
| Zg |
| 64g/mol |
| Z |
| 64 |
| ||
����⣺��1��ͨ�������õ��������Һ�����øò����ǹ��ˣ������ǰѲ����Թ������Һ�ֿ��IJ�����
�ʴ�Ϊ�����ˣ�
��2��FeCl3���������ԣ��������ͭ��������Ӧ����ʽΪ��2FeCl3+Fe=3FeCl2��2FeCl3+Cu=2FeCl2+CuCl2��
�ʴ�Ϊ��FeCl3+Fe=3FeCl2��2FeCl3+Cu=2FeCl2+CuCl2��
��3���������������Һ�к�ͭ����������Ļ�ԭ��Ŀ���ǻ�ԭ�������Ȼ�������Ӧ��ͭ���ʴ�Ϊ��ͭ�ۣ�
��4������Һb�к��������ӣ��ᱻ���Ը�����������������ӣ�������ر���ԭΪ�����ӣ���Ӧ�����ӷ���ʽΪMnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O��
�ʴ�Ϊ��MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O��
�ڸ��ݹ�ϵʽ���㣺
2 MnO4-��10Fe2+��5Fe2O3
2 10 5��160g
0.001XY m
m=
=0.4XY��
�ʴ�Ϊ��0.4XY��
��5����Ksp[Cu��OH��2]=2.2��10-20��Ksp[Fe��OH��3]=4.0��10-38��Ksp[Mn��OH��2]=1.9��10-13��
�ܶȻ�����ԽС����Ӧ����Խ�׳������ʳ���˳��Ϊ��Fe3+��Cu2+��Mn2+��
�ʴ�Ϊ��Fe3+��Cu2+��Mn2+��
��6�������̿�֪������Ȼ�ͭ�õ�ͭ������������Zg ͭת�Ƶ�����Ϊ��
��2=
mol������������
mol��Ҫʹ�����õ����������ͬ����Ҫ���ˮ������ˮ�����ʵ���Ϊx�����ݷ�Ӧʽ��2H2O
H2��+O2����֪������xmol������0.5xmol�����������������������ȿ��г����̣�
mol+0.5xmol=xmol�����x=
�����������������ʵ���Ϊ��
mol������������
mol��22.4L/mol=
L�����������ĵ缫��ӦʽΪ��4OH--4e-=O2��+4H2O��
�ʴ�Ϊ��
��4OH--4e-=O2��+4H2O��
�ʴ�Ϊ�����ˣ�
��2��FeCl3���������ԣ��������ͭ��������Ӧ����ʽΪ��2FeCl3+Fe=3FeCl2��2FeCl3+Cu=2FeCl2+CuCl2��
�ʴ�Ϊ��FeCl3+Fe=3FeCl2��2FeCl3+Cu=2FeCl2+CuCl2��
��3���������������Һ�к�ͭ����������Ļ�ԭ��Ŀ���ǻ�ԭ�������Ȼ�������Ӧ��ͭ���ʴ�Ϊ��ͭ�ۣ�
��4������Һb�к��������ӣ��ᱻ���Ը�����������������ӣ�������ر���ԭΪ�����ӣ���Ӧ�����ӷ���ʽΪMnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O��
�ʴ�Ϊ��MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O��
�ڸ��ݹ�ϵʽ���㣺
2 MnO4-��10Fe2+��5Fe2O3
2 10 5��160g
0.001XY m
m=
| 0.001XY��5��160g |
| 2 |
�ʴ�Ϊ��0.4XY��
��5����Ksp[Cu��OH��2]=2.2��10-20��Ksp[Fe��OH��3]=4.0��10-38��Ksp[Mn��OH��2]=1.9��10-13��
�ܶȻ�����ԽС����Ӧ����Խ�׳������ʳ���˳��Ϊ��Fe3+��Cu2+��Mn2+��
�ʴ�Ϊ��Fe3+��Cu2+��Mn2+��
��6�������̿�֪������Ȼ�ͭ�õ�ͭ������������Zg ͭת�Ƶ�����Ϊ��
| Zg |
| 64g/mol |
| Z |
| 32 |
| Z |
| 64 |
| ||
| Z |
| 64 |
| Z |
| 32 |
| Z |
| 64 |
| Z |
| 64 |
| 22.4Z |
| 64 |
�ʴ�Ϊ��
| 22.4Z |
| 64 |
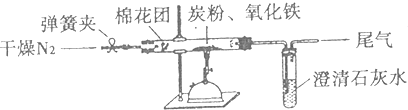
���������⿼����ʵ�鷽������ƣ����ʵ��������������ʵķ�������ӣ����ӷ���ʽ����д�������ܽ�ƽ�⼰���ԭ������Ŀ���ѣ�Ҫ�����������̣���ʵ��Ŀ�ij���Χ��������ݻ�ѧԭ��һ�������

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ


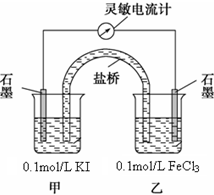 ij�о���ѧϰС��Ϊ֤��2Fe3++2I-?2Fe2++I2Ϊ���淴Ӧ������Ӧ����һ�����ȣ���������¼��ַ�������֪FeF63-��һ����ɫ���ȶ��������ӣ�
ij�о���ѧϰС��Ϊ֤��2Fe3++2I-?2Fe2++I2Ϊ���淴Ӧ������Ӧ����һ�����ȣ���������¼��ַ�������֪FeF63-��һ����ɫ���ȶ��������ӣ�