题目内容
【题目】已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10个电子分子,B、C属同一周期,两者可以形成许多种共价化合物,C、F属同一主族,B原子最外电子层的p能级上的电子处于半满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1。请用具体的元素回答下列问题:
(1)E元素原子基态电子排布式____________。
(2)F元素原子的价电子排布图________________。
(3)F、G元素对应的最高价含氧酸中酸性较强的分子式为__________________。
(4)离子半径D+______B3-,第一电离能B______C,电负性C______F(填“<”、“>”或“=”)。
(5)A、C形成的两种常见分子中,其中一种为绿色氧化剂的电子式为_________。
(6)基态G原子中,电子占据的最高能层符号是_______,该能层有________个能级,电子数是_____。该原子有_____种运动状态不同的电子,最高能级符号是_____,未成对电子数为________。
(7)与E同族有4个能层的元素符号为______,它的简化电子排布式为______,与该元素同周期且核电荷数小7的元素在周期表中的位置______________,该元素的价电子排布式为__________,_________满足构造原理(填“是”或“否”)。
【答案】1s22s22p63s23p1 ![]() HClO4 < > >
HClO4 < > > ![]() M 3 7 17 3p 1 Ga [Ar]3d104s24p1 第四周期第VIB族 3d54s1 否
M 3 7 17 3p 1 Ga [Ar]3d104s24p1 第四周期第VIB族 3d54s1 否
【解析】
A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大,A是周期表中原子半径最小的元素,则A是H元素,D3B中阴、阳离子具有相同的电子层结构,B原子最外电子层的p能级上的电子处于半满状态,为第VIA族元素,B为-3价、D为+1价且D是金属元素,D的原子序数大于B、C,则D为Na元素、B为N元素,B、C均可分别与A形成10个电子分子,B、C属同一周期,两者可以形成许多种共价化合物,C的最外层电子数是内层电子数的3倍,则C是O元素,C、F属同一主族,则F是S元素,E最外层电子数比最内层多1,则E最外层电子数为3,E是Al元素,G的原子序数大于F,且为短周期主族元素,则G是Cl元素,再结合物质结构分析解答。
通过以上分析知,A为H,B为N,C为O,D为Na,E为Al,F为S,G为Cl;
(1)E是Al元素,其原子核外有13个电子,根据构造原理知其基态原子核外电子排布式为1s22s22p63s23p1;
(2)F为S元素,其价电子为3s、3p电子,其价电子排布图为![]() ;
;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,Cl元素的非金属性大于S元素,则F、G元素对应的最高价含氧酸中酸性较强的分子式为HClO4;
(4)电子层结构相同的离子,离子半径随着原子序数的增大而减小,所以离子半径D+<B3;N与O位于同一周期相邻元素,N原子最外电子层的p能级上的电子处于半满状态,电子较O相比难以失去,故第一电离能:B>C;C是O元素、F是S元素,同一主族元素中,电负性随着原子序数的增大而减小,所以电负性C>F,故答案为:<;>;>;
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比1:1,则X是双氧水,其电子式为![]() ;
;
(6)基态Cl原子核外电子排布式为1s22s22p63s23p5,电子占据最高能层为第三能层,能层符号为M;该能层中有s、p、d三个能级;第三能层中电子数为2+5=7;Cl原子中电子数为17,因此共有17中运动状态不同的电子;最高能级符号为3p;外围电子排布图为:![]() ,核外未成对电子数为1;
,核外未成对电子数为1;
(7)Al位于IIIA族,第四周期IIIA族元素为Ga;简化电子排布式为:[Ar]3d104s24p1;IIIA族位于从左至右的第13列,因此同周期且核电荷数小7的元素在周期表中的位置为第四周期第6列,即第四周期第VIB族;该元素核外电子排布式为:1s22s22p63s23p63d54s1,价层电子排布式为:3d54s1;其满足洪特规则特例,不满足构造原理。

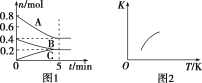
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.增大压强使平衡向生成Z的方向移动,平衡常数增大
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.反应达到平衡时,X的转化率为50%
D.增大X的浓度,Y的转化率增大