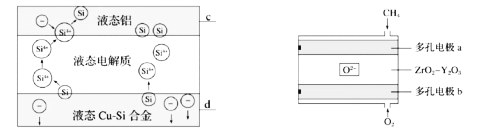
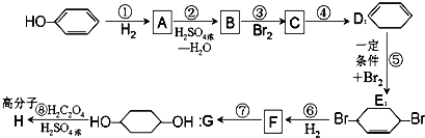
题目内容
【题目】叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3。HN3的酸性和醋酸相近,可微弱电离出H+和N3-。试回答下列问题:
(1)下列有关说法正确的是___(填序号)。
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.N2H4沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮酸根能与许多金属离子等形成配合物,如[Co(N3)(NH3)5]SO4,在该配合物中钴显___价;根据价层电子对互斥理论判断SO42-的空间构型为___。
(3)与N3-互为等电子体的分子有___(写两种即可)。
【答案】CD +3 正四面体形 CO2、CS2
【解析】
(1)A.根据HN3的分子结构可知,HN3分子中存在3个σ键,故A错误;
B.HN3分子中连接三键的氮原子为sp杂化,故B错误;
C.HN3、HNO2、H2O、N2H4分子的正、负电荷中心不重合,都是极性分子,故C正确;
D.N2H4为分子化合物,N元素电负性较高,能够形成分子间氢键,分子间氢键的存在会使物质的熔、沸点升高,故D正确;
故答案为:CD;
(2)[Co(N3)(NH3)5]SO4中![]() 带1个单位负电荷,NH3不带电荷,
带1个单位负电荷,NH3不带电荷,![]() 带2个单位负电荷,根据化合物中元素化合价的代数和等于零可知,[Co(N3)(NH3)5]SO4中钴显+3价;硫酸根离子中S原子的价层电子对数为
带2个单位负电荷,根据化合物中元素化合价的代数和等于零可知,[Co(N3)(NH3)5]SO4中钴显+3价;硫酸根离子中S原子的价层电子对数为![]() ,无孤电子对,故其空间构型为正四面体形;
,无孤电子对,故其空间构型为正四面体形;
(3)互为等电子体的粒子必须满足两个条件:①所含原子总数相等;②所含价电子总数相等,![]() 价电子总数为3×5+1=16,因此与
价电子总数为3×5+1=16,因此与![]() 互为等电子体的分子有CO2、CS2。
互为等电子体的分子有CO2、CS2。