题目内容
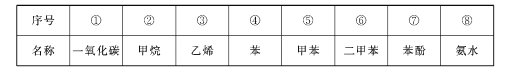
【题目】下表是元素周期表短周期的一部分
① | ||||||||
② | ③ | ④ | ||||||
⑤ | ⑥ | ⑦ | ⑧ | |||||
(1)①~⑦元素中金属性最强的元素是___________(用元素符号表示)。
(2)④与⑤形成的化合物的电子式为____________。
(3)表中元素②、③、⑦最高价含氧酸的酸性由强到弱的顺序是___________(填化学式)。
(4)第116号元素(元素符号Lv)被中国科学技术名词审定委员会命名为“![]() ”,该元素在元素周期表中的位置是_____________。
”,该元素在元素周期表中的位置是_____________。
(5)核内中子数为N的R2+,质量数为A,则ng它的相同价态氧化物中所含的电子的物质的量约为________mol。
【答案】Mg ![]() HNO3>H2CO3 >H2SiO3 第七周期第VIA族 n(A-N+8)/(A+16)
HNO3>H2CO3 >H2SiO3 第七周期第VIA族 n(A-N+8)/(A+16)
【解析】
由元素在周期表中位置,可知①为H、②为C、③为N、④为F、⑤为Mg、⑥为Al、⑦为Si、⑧为S。
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强;
(2)④与⑤形成的化合物为离子化合物MgF2;
(3)元素非金属性越强,其最高价氧化物的水化物的酸性越强;
(4) 已知元素的原子序数判断元素在周期表中的位置,方法之一是参照ⅠA族和0族元素原子序数法;
(5) 该离子带2个单位正电荷,所以其氧化物的化学式为RO。
由元素在周期表中位置,可知①为H、②为C、③为N、④为F、⑤为Mg、⑥为Al、⑦为Si、⑧为S。
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故①~⑦元素中金属性最强的元素是Mg;
(2)④与⑤形成的化合物为离子化合物MgF2,由镁离子和氟离子构成,其电子式为![]() ;
;
(3)元素非金属性越强,其最高价氧化物的水化物的酸性越强,元素②、③、⑦最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3 >H2SiO3;
(4) 已知元素的原子序数判断元素在周期表中的位置,方法之一是参照ⅠA族和0族元素原子序数法;元素周期表第七周期的ⅠA族元素原子序数为87,0族元素原子序数为118,87<116<118。故116号元素在周期表的第七周期ⅥA族;
(5) 该离子带2个单位正电荷,所以其氧化物的化学式为RO,该氧化物的摩尔质量为(A+16)g/mol,n g 它的氧化物的物质的量为![]() ;一个氧化物分子中含有(A-N+8)个中子,所以ng 它的氧化物中所含质子的物质的量为
;一个氧化物分子中含有(A-N+8)个中子,所以ng 它的氧化物中所含质子的物质的量为
![]() ×(A-N+8)=
×(A-N+8)=![]() (A-N+8)mol。
(A-N+8)mol。

【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1) NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。

①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
②已知下列反应:
SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) ===SO42 (aq)+Cl (aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42(aq)ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=______。