题目内容
19. (1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片(如图甲所示),可观察到铜片上没有(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上有 (填“有”或“没有”)气泡产生.
(1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片(如图甲所示),可观察到铜片上没有(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上有 (填“有”或“没有”)气泡产生.(2)图乙中的现象说明溶液中的H+移向了铜极(填“锌”或“铜”),铜电极得到电子(填“得到”或“失去”),在锌电极发生氧化反应(填“氧化”或“还原”),其电极反应式为 Zn-2e-═Zn2+.
分析 (1)金属铜不能和酸反应置换出氢气,在原电池中,产生气泡的极只能是正极;
(2)图乙构成铜锌原电池,正极发生得电子得还原反应,负极发生失电子的氧化反应,阳离子移向正极,据此分析.
解答 解:(1)将铜插到硫酸中,金属铜不能和酸反应置换出氢气,再用导线把锌片和铜片连接起来,会形成Zn、Cu、硫酸原电池,在正极上氢离子得电子产生氢气,
故答案为:没有;有;
(2)图乙构成铜锌原电池,正极铜电极发生得电子得还原反应,负极锌发生失电子的氧化反应,反应为Zn-2e-=Zn2+;阳离子H+移向正极铜,故答案为:铜;得到;氧化;Zn2+.
点评 本题考查原电池的概念和工作原理知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
18.下列离子式方程正确的是( )
| A. | 稀硝酸与氢氧化钡溶液反应:H++OH-═H2O | |
| B. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 碳酸钠与稀硝酸反应:Na2CO3+2H+═2Na++CO2↑+H2O | |
| D. | 氯化铝溶液与过量氨水反应:Al3++OH-═Al(OH)3↓ |
7.从柑橘中炼制萜二烯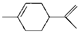 ,下列有关它的推测,不正确的是( )
,下列有关它的推测,不正确的是( )
 ,下列有关它的推测,不正确的是( )
,下列有关它的推测,不正确的是( )| A. | 分子式为C10 H16 | |
| B. | 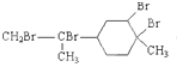 与过量的溴的CCl4溶液反应后产物如图 | |
| C. | 它不能使酸性高锰酸钾溶液褪色 | |
| D. | 常温下为液态,难溶于水 |
11.下列实验操作与相对应实验目的正确的是
( )
| 实验操作 | 实验目的 | |
| A | C2H4与SO2混合气体通过盛有溴水的洗气瓶 | 除去C2H4中的SO2 |
| B | 制乙炔时用饱和食盐水代替水 | 减慢化学反应速率 |
| C | 淀粉溶液水解后冷却至室温,加碘水观察现象 | 检验淀粉是否完全水解 |
| D | 将溴乙烷与氢氧化钠水溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验溴乙烷中的溴原子 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
8.下列化合物分子中,在核磁共振氢谱图中能给出三种信号的是( )
| A. | CH3CH2CH3 | B. | (CH3)2CHOH | C. | CH3CH2OCH2CH3 | D. | HCOOCH2CH2OOCH |
 .
. Na2CO3+CO2↑+H2O.
Na2CO3+CO2↑+H2O.