题目内容
10.无水AlCl3可用作有机合成的催化剂、食品膨松剂等.工业制备无水AlCl3的流程如下: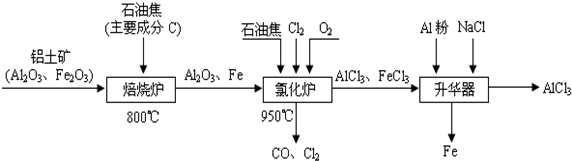
(1)已知:C(s)+$\frac{1}{2}$O2(g)═CO(g);△H=-110.5kJ•mol-1 ①
2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s);△H=-822.1kJ•mol-1 ②
请写出C还原Fe2O3生成CO的热化学方程式3C(s)+Fe2O3(s)═3CO(g)+2Fe(s)△H=+490.6kJ/mol.
(2)氯化炉中通入O2的目的是与C反应,提供反应所需的热量.
(3)氯化炉中Al2O3、Cl2和C反应的化学方程式是A12O3+3C12+3C$\frac{\underline{\;高温\;}}{\;}$ 2A1C13+3CO.
(4)氯化炉中导出的气体,通常用亚硫酸钠溶液来吸收,请写出用Na2SO3溶液处理尾气时发生反应的离子方程式SO32-+Cl2+H2O=SO42-+2H++2Cl-.
(5)在升华器中加入铝粉的目的是除去FeCl3.
分析 铝土矿焙烧炉中加热反应,得到氧化铝和铁,加入氯气、氧气和石油焦在氯化炉中反应,氯化炉中通入O2,与碳反应放热,维持950℃的温度,升华器中含有AlCl3等,所以Al2O3、C12和C反应会生成A1C13,由冷凝器尾气可知还会生成CO,氯化铝中含有氯化铁,加入铝粉除去,最后得到氯化铝冷凝得到氯化铝固体;
(1)由盖斯定律定律,将第一个热化学方程式乘以3,减去第二个热化学方程式,计算反应热,并写出热化学方程式;
(2)氯化炉中通入O2,与碳反应放热,维持950℃的温度;
(3)根据工艺流程可知升华器中含有AlCl3等,所以Al2O3、C12和C反应会生成A1C13,由冷凝器尾气可知还会生成CO;
(4)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-;
(5)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除去FeCl3.
解答 解:(1)C还原Fe2O3生成CO的热化学方程式:3C(s)+Fe2O3(s)═3CO(g)+2Fe(s);△H
由盖斯定律,将第一个将第一个热化学方程式乘以3,减去第二个热化学方程式,即得该热化学方程式,
反应热△H=3×(-110.5kJ/mol)-(-822.1kJ/mol)=+490.6kJ/mol;
所以C还原Fe2O3生成CO的热化学方程式为:3C(s)+Fe2O3(s)═3CO(g)+2Fe(s)△H=+490.6kJ/mol;
故答案为:3C(s)+Fe2O3(s)═3CO(g)+2Fe(s)△H=+490.6kJ/mol;
(2)氯化炉中通入O2,与碳反应放热,维持950℃的温度,
故答案为:与C反应,提供反应所需的热量;
(3)根据工艺流程可知氯化炉的产物,经冷却、升华可制备无水AlCl3,说明氯化炉的产物中含有A1C13,冷凝器尾气含有CO,所以Al2O3、C12和C反应,生成A1C13和CO,反应方程式为A12O3+3C12+3C$\frac{\underline{\;高温\;}}{\;}$2A1C13+3CO,
故答案为:A12O3+3C12+3C$\frac{\underline{\;高温\;}}{\;}$2A1C13+3CO;
(4)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-.反应离子方程式为SO32-+C12+H2O═SO42-+2C1-+2H+,
故答案为:SO32-+C12+H2O═SO42-+2C1-+2H+;
(5)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除FeCl3去.所以加入少量Al目的是除去FeCl3,
故答案为:除去FeCl3.
点评 本题考查化学方程式离子方程式的书写、物质的分离和提纯、纯度等,题目难度适中,注意将AlCl3•6H2O脱水制备无水氯化铝可在HCl气流中加热脱结晶水.

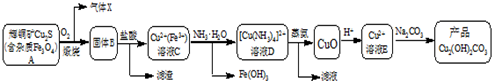
已知:[Cu(NH3)4]2+(aq)═Cu2+(aq)+4NH3(aq)根据以上工艺流程,下列说法不正确的是( )
| A. | 气体X中含有SO2 | |
| B. | 为实现溶液C到溶液D的转化,加NH3•H2O至红棕色沉淀刚好完全,过滤即可 | |
| C. | 蒸氨过程发生总反应的化学方程式为:[Cu(NH3)4]Cl2+H2O$\frac{\underline{\;加热\;}}{\;}$CuO+2HCl↑+4NH3↑ | |
| D. | 在制备产品时,溶液D中不直接加入Na2CO3溶液的原因是游离的Cu2+浓度太低 |
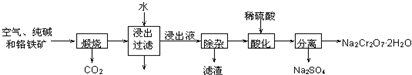
| A. | 含CrOi${\;}_{4}^{2-}$、Ba2+的废水属于重金属污染 | |
| B. | 从物质分类的角度看.除去多余的Ba2+.所加的试剂类型为硫酸盐 | |
| C. | 加入可溶性钡盐后,废水中人可溶性沏盐后,废水中Ba〃的浓度应不小于2+的浓度应不小于2.4×10-2mol.L-1 | |
| D. | BaCrO4与碳酸钙类似均属于电解质 |
| A. | 向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2 | |
| B. | 在高温条件下,C能置换出SiO2中的Si,说明C的氧化性强于Si | |
| C. | 在空气中加热铝箔,发现内部的铝熔化但不滴落,说明铝不易与氧气反应 | |
| D. | 工业上用铝制容器盛装浓硫酸,说明常温下铝和浓硫酸不反应 |
 反应A(g)?B(g)+C(g)在容积为2.0L的密闭容器中进行,初始时加入0.10mol A.温度T1和T2下,A的浓度与时间关系如图所示.
反应A(g)?B(g)+C(g)在容积为2.0L的密闭容器中进行,初始时加入0.10mol A.温度T1和T2下,A的浓度与时间关系如图所示. (1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片(如图甲所示),可观察到铜片上没有(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上有 (填“有”或“没有”)气泡产生.
(1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片(如图甲所示),可观察到铜片上没有(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上有 (填“有”或“没有”)气泡产生.