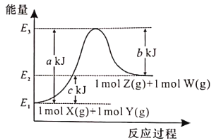
题目内容
【题目】25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃32mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合烃中乙炔的体积分数为( )
A.75%B.50%C.25%D.12.5%
【答案】C
【解析】
乙烷的分子式为C2H6,1mol乙烷完全燃烧生成液态水的方程式为:![]() ,因此1mol乙烷完全燃烧生成液态水会使气体总物质的量减少2.5mol;乙炔的分子式为C2H2,1mol乙炔完全燃烧生成液态水的方程式为:
,因此1mol乙烷完全燃烧生成液态水会使气体总物质的量减少2.5mol;乙炔的分子式为C2H2,1mol乙炔完全燃烧生成液态水的方程式为:![]() ,因此1mol乙炔完全燃烧生成液态水会使气体总物质的量减少1.5mol;丙烯的分子式为C3H6,1mol丙烯完全燃烧生成液态水的方程式为:
,因此1mol乙炔完全燃烧生成液态水会使气体总物质的量减少1.5mol;丙烯的分子式为C3H6,1mol丙烯完全燃烧生成液态水的方程式为:![]() ,因此1mol丙烯完全燃烧生成液态水会使气体总物质的量减少2.5mol,与乙烷的相同;不妨假设32mL中乙炔的体积为xmL,那么乙烷和丙烷的总体积为(32-x)mL;根据上述的燃烧规律列式:
,因此1mol丙烯完全燃烧生成液态水会使气体总物质的量减少2.5mol,与乙烷的相同;不妨假设32mL中乙炔的体积为xmL,那么乙烷和丙烷的总体积为(32-x)mL;根据上述的燃烧规律列式:![]() ,解得x=8mL,所以乙炔的体积分数为25%,C项正确;
,解得x=8mL,所以乙炔的体积分数为25%,C项正确;
答案选C。

练习册系列答案
相关题目
【题目】某同学利用菱镁矿(主要含MgCO3,FeCO3杂质)制取碱式氯化镁[Mg(OH)Cl]的流程。已知:MgO用于调节沉淀池中溶液的pH值。
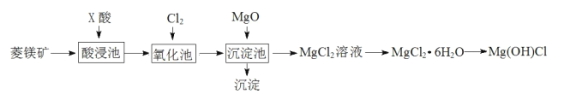
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Mg2+ | 8.8 | 11.4 |
下列说法不正确的是( )
A.酸浸池中加入的![]() 酸可以是硫酸
酸可以是硫酸
B.加入MgO后的沉淀一定含有Fe(OH)3
C.氧化池中通入氯气的目的是将Fe2+氧化为Fe3+
D.制得碱式氯化镁的方程式为:MgCl2·6H2O![]() Mg(OH)Cl+HCl↑+5H2O↑
Mg(OH)Cl+HCl↑+5H2O↑