题目内容
【题目】![]() 、
、![]() 、
、![]() 三种元素的原子具有相同的电子层数,
三种元素的原子具有相同的电子层数,![]() 原子的核电荷数比
原子的核电荷数比![]() 原子的核电荷数大2,
原子的核电荷数大2,![]() 原子的电子总数比
原子的电子总数比![]() 原子的电子总数大4;
原子的电子总数大4;![]() 单质
单质![]() 与足量
与足量![]() 溶液反应可生成
溶液反应可生成![]() (标准状况下)氢气,此时
(标准状况下)氢气,此时![]() 转化为与氖原子具有相同电子层结构的离子。
转化为与氖原子具有相同电子层结构的离子。
(1)写出各元素的名称:![]() ______,
______,![]() ______,
______,![]() ______。
______。
(2)写出![]() 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与![]() 的简单氢化物的水溶液反应的离子方程式:____________。
的简单氢化物的水溶液反应的离子方程式:____________。
(3)![]() 形成的简单离子的氧化性比
形成的简单离子的氧化性比![]() 形成的简单离子的氧化性______ (填“强”或“弱”),其原因是______。
形成的简单离子的氧化性______ (填“强”或“弱”),其原因是______。
【答案】钠 铝 氯 ![]() 弱
弱 ![]() 原子比
原子比![]() 原子易失电子,单质
原子易失电子,单质![]() 的还原性比单质
的还原性比单质![]() 的强
的强
【解析】
A、B、C三种元素的原子具有相同的电子层数,1molA的单质能跟足量的盐酸反应,在标准状况下可置换出11.2L的H2,即0.5mol,A为金属,令A反应后化合价为x,则根据电子转移守恒,1x=0.5×2,所以x=1,即A反应后为+1价,这时A转变为与氖原子具有相同电子层结构的离子,则A为Na元素.而B的核电荷数比A大2,则B为Al元素;C原子的电子总数比B原子的电子总数多4,则C为Cl元素,结合元素单质、化合物的性质解答该题。
根据上述分析可知,(1)![]() 单质
单质![]() 与足量
与足量![]() 溶液反应可生成
溶液反应可生成![]() (标准状况下)氢气,则该反应中
(标准状况下)氢气,则该反应中![]() 失去
失去![]() 电子,此时
电子,此时![]() 转化为与氖原子具有相同电子层结构的离子,可知
转化为与氖原子具有相同电子层结构的离子,可知![]() 是
是![]() ,从而确定
,从而确定![]() 是
是![]() ,
,![]() 是
是![]() 。
。
(2)![]() 的最高价氧化物对应的水化物是
的最高价氧化物对应的水化物是![]() ,
,![]() 的简单氢化物为
的简单氢化物为![]() ,
,![]() 与盐酸反应的离子方程
与盐酸反应的离子方程![]() 。
。
(3)单质钠的还原性比铝强,所以![]() 的氧化性比
的氧化性比![]() 弱。
弱。

【题目】数十亿年来,地球上的物质不断的变化,大气的成分也发生了很大的变化.下表是原始大气和目前空气的主要成分,用下表涉及的分子回答下列问题。
原始大气的主要成分 | CH4、NH3、CO、CO2等 |
目前空气的主要成分 | N2、O2、CO2、水蒸气、稀有气体(He、Ne等) |
(1)含有非极性共价键的分子是______(填化学式)
(2)含有极性共价键的非极性分子是______(填化学式)
(3)H2O中心原子的杂化方式及分子构型为______
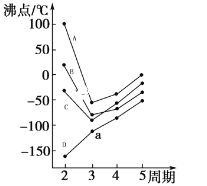
(4)图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物。其中代表CH4的是______(填字母序号)
(5)根据NH3H2ONH4++OH-,用氢键表示式写出氨分子和水分子之间最主要存在的氢键形式______
【题目】储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。
(1)请用双线桥法标出电子转移方向和数目___。
(2)上述反应中氧化剂是___(填化学式),被氧化的元素是___(填元素符号)。
(3)H2SO4在上述反应中表现出来的性质是___(填序号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为___L。
(5)下列离子方程式的书写及评价均合理的是___。
选项 | 离子方程式 | 评价 |
A | 将1molCl2通入含1molFeI2溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | 1mol·L-1的NaAlO2溶液和2.5mol·L-1的HCl溶液等体积互相均匀混合:2AlO2-+5H+=Al3++Al(OH)3↓+H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2∶3 |
C | 过量SO2通入NaClO溶液中:SO2+H2O+ClO-=HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | Ca(HCO3)2溶液与足量的NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
(6)将一定量Mg、Al合金溶于1mol·L-1的HC1溶液中,进而向所得溶液中滴加1mol·L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示。下列结论中正确的是___。
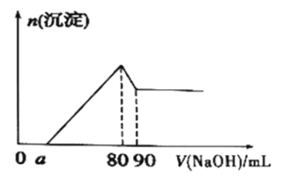
A.溶解“一定量Mg、A1合金”的HC1溶液的体积为90mL
B.Al的物质的量为0.01mol
C.可算出实验中产生H2的物质的量为0.04mol
D.若a=20,可算出Mg的物质的量为0.04mol