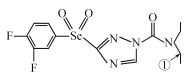
��Ŀ����
����Ŀ����ʮһ�����ѽ���Ϊ������֮��ĵ������������ҵ����������Ϊԭ���Ʊ��������Ѽ��ѵĹ�����������ͼ��ʾ�����������Ҫ�ɷ�Ϊ��������(FeTiO3)������һ������Ԫ���ڷ绯�����л�ת��Ϊ��3�ۣ�FeTiO3�������TiԪ����TiO2+���ڣ�TiOSO4��ˮ��ˮ�⡣
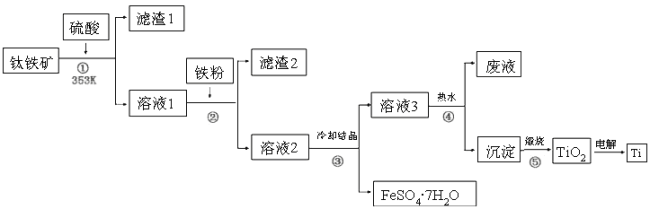
�����������Ϣ�ش��������⣺
��1�����м������۵�Ŀ����__________��
��2�����л��������������________(����ĸ���)��
a���ۡ��е���� b���ܽ��Բ��� c�������ԡ���ԭ�Բ���
��3�������������о���Ҫ���еIJ�����________(���������)��
��4��д���������ӷ���ʽ��_______________���ù�������ˮ�в�����Ŀ����_________
��5���������������еķ�Һ�����̿�(��Ҫ�ɷ�ΪMnO2)��Ӧ������������(MnSO4��������ˮ)���÷�Ӧ�����ӷ���ʽΪ_______________��
��6����ѧ�Ҵӵ��ұ�����Ĺ��յõ�����.�ҳ���ұ���ѵ��¹��ա�
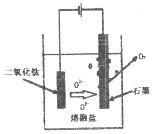
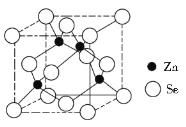
��ֱ�ӵ�����TiO2�������ѣ�ԭ����ͼ��ʾ������������ѵĵ缫��ӦΪ_____________��
�����һ��ʱ�����Ҫ����ʯī�缫��ԭ����_____________��
���𰸡���1����ȥFe3������2��b��3������
��4��TiO2����2H2O![]() H2TiO3��2H��������ˮ�ⷴӦ���ȣ������¶�������ˮ��ƽ��������Ӧ�����ƶ������H2TiO3�IJ�����5��MnO2��2Fe2����4H��===Mn2����2Fe3����2H2O��6����TiO2+4e-=Ti+2O2-����O2--2e-+C=CO
H2TiO3��2H��������ˮ�ⷴӦ���ȣ������¶�������ˮ��ƽ��������Ӧ�����ƶ������H2TiO3�IJ�����5��MnO2��2Fe2����4H��===Mn2����2Fe3����2H2O��6����TiO2+4e-=Ti+2O2-����O2--2e-+C=CO
��������
������������̷����������������ܽ�����TiO2+��Fe2+�������������ۻ�ԭFe3+�����˳�ȥ��������������ȴ�ᾧ�����˵õ�FeSO47H2O�ͺ���TiO2+����Һ������������PH��ʹTiO2+ˮ������Ti(OH)4�����˵õ�Ti(OH)4��������Ti(OH)4���ȷֽ����ɻ�����TiO2�������TiO2�õ��ѡ�
��1�����м������۵���ҪĿ���ǽ�Fe3+ת��ΪFe2+����ֹFe2+���������ʴ�Ϊ����ȥFe3����
��2��������У������̷���TiOSO4���ܽ��ԵIJ���ʵ�ֻ����ķ��룬�ѻ�������Һ��ȴ�ᾧ�õ��̷����壬�ʴ�Ϊ��b��
��3�����������������о�Ϊ�����Һ�����IJ����������Ϊ���ˣ��ʴ�Ϊ�����ˣ�
��4�������������ӷ���ʽΪTiO2����2H2O![]() H2TiO3��2H��������ˮ�ⷴӦ���ȣ������¶�������ˮ��ƽ��������Ӧ�����ƶ������H2TiO3�IJ��ʣ�����ù�������ˮ�����У��ʴ�Ϊ��TiO2����2H2O
H2TiO3��2H��������ˮ�ⷴӦ���ȣ������¶�������ˮ��ƽ��������Ӧ�����ƶ������H2TiO3�IJ��ʣ�����ù�������ˮ�����У��ʴ�Ϊ��TiO2����2H2O![]() H2TiO3��2H��������ˮ�ⷴӦ���ȣ������¶�������ˮ��ƽ��������Ӧ�����ƶ������H2TiO3�IJ�����
H2TiO3��2H��������ˮ�ⷴӦ���ȣ������¶�������ˮ��ƽ��������Ӧ�����ƶ������H2TiO3�IJ�����
��5�����������еķ�Һ����Fe2+����MnO2����������ԭ��Ӧ���������̣��䷴Ӧ�����ӷ���ʽΪ��MnO2+2Fe2++4H+�TMn2++2Fe3++2H2O���ʴ�Ϊ��MnO2+2Fe2++4H+�TMn2++2Fe3++2H2O��
��6�������ʱ�������ϵõ��ӷ�����ԭ��Ӧ�����Զ������ѵõ��������Ѻ������ӣ��͵�Դ�����������缫��ӦʽΪTiO2+4e-=Ti+2O2-���ʴ�Ϊ��TiO2+4e-=Ti+2O2-��
�����һ��ʱ������ɵ���������ʯī�缫��Ӧ����CO��O2--2e-+C=CO����Ҫ��ʱ����ʯī�缫���ʴ�Ϊ��O2--2e-+C=CO��