题目内容
15.图中各方框中的字母表示有关的一种反应物或生成物(某些物质略去),常温下B、D、G、I、J为气体,其中B可使湿润的红色石蕊试纸变蓝,E为淡黄色固体,A~N的所有物质中只有G为单质,其余为化合物.N为不溶于水的无机酸.
回答下列问题:
(1)A的名称为碳酸铵或碳酸氢铵,F的化学式是NaOH; L的化学式是SiO2.
(2)写出实验室制取I的离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)写出B+G反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(4)在反应C+E→G+F中,每生成1mol G转移2mol电子.
(5)标准状况下,将2.24L的I和J组成的混合气体通入足量水中,气体体积缩小为1.12L,则混合气体中I与J的体积比为1:3.
分析 B为气体,可使湿润的红色石蕊试纸变蓝,则B为NH3.E为淡黄色固体,D为气体,二者反应生成气体单质G,则E为Na2O2,D为CO2,G为O2,H为Na2CO3,而C与过氧化钠反应也生成氧气与F,可推知C为H2O,F为NaOH.由A$\stackrel{△}{→}$NH3+H2O+D,D为气体,故A为碳酸铵或碳酸氢铵,由转化关系NH3$\stackrel{G}{→}$I$\stackrel{G}{→}$J,可知I为NO,J为NO2,J与C反应生成K为HNO3.N为不溶于水的无机酸,为H2SiO3,由HNO3+M→H2SiO3,可知M为硅酸盐,由氢氧化钠与碳酸钠都能与L反应生成M,故L为SiO2,M为Na2SiO3,验证符合题意,据此解答.
解答 解:B为气体,可使湿润的红色石蕊试纸变蓝,则B为NH3.E为淡黄色固体,D为气体,二者反应生成气体单质G,则E为Na2O2,D为CO2,G为O2,H为Na2CO3,而C与过氧化钠反应也生成氧气与F,可推知C为H2O,F为NaOH.由A$\stackrel{△}{→}$NH3+H2O+D,D为气体,故A为碳酸铵或碳酸氢铵,由转化关系NH3$\stackrel{G}{→}$I$\stackrel{G}{→}$J,可知I为NO,J为NO2,J与C反应生成K为HNO3.N为不溶于水的无机酸,为H2SiO3,由HNO3+M→H2SiO3,可知M为硅酸盐,由氢氧化钠与碳酸钠都能与L反应生成M,故L为SiO2,M为Na2SiO3,验证符合题意.
(1)由上述分析可知,A为碳酸铵或碳酸氢铵,F为NaOH,L为SiO2,
故答案为:碳酸铵或碳酸氢铵;NaOH;SiO2;
(2)实验室用Cu与稀硝酸反应制备NO,离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)B+G反应是氨气催化氧化生成一氧化氮与氧气,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(4)在反应2Na2O2+2H2O=4NaOH+O2↑中,Na2O2即使氧化剂又是还原剂,各占一半,每生成1molO2转移电子的物质的量为:1mol×2=2mol;
故答案为:2;
(5)标准状况下,将2.24L的NO和NO2,组成的混合气体通入足量水中,气体体积缩小为1.12L,则:
3NO2+2H2O=2HNO3+NO 气体体积减少
3 2
1.68L 2.24L-1.12L=1.12L
混合物中NO的体积为2.24L-1.68L=0.56L,
则混合气体中NO和NO2的体积比为0.56L:1.68L=1:3,
故答案为:1:3.
点评 本题考查无机物推断,物质的特殊性质、特殊反应等是推断突破口,在熟练掌握元素化合物知识的基础上着重考查学生的发散思维、分析判断、逻辑思维以及对无机物知识的综合应用等能力,难度中等.

| A. | 7:2 | B. | 4:7 | C. | 7:4 | D. | 9:8 |
| A. | ns2np3 | B. | ns2np5 | C. | ns2np4 | D. | ns2np6 |
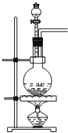
| A. | Cl2 | B. | C2H4 | C. | C2H2 | D. | CO2 |
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
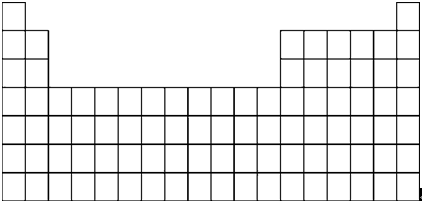
(2)在上面的元素周期表中,用斜线标出通常寻找催化剂材料的区域
(3)以上10种元素的原子中,最容易失去电子的是K(填元素符号);与H2最容易化合的非金属单质是氟气(写物质名称).
(4)用电子式表示元素③形成的氢化物过程

(5)写出上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式CCl4或PCl3.某元素R的原子半径为1.02×10-10m,该元素在周期表中位于第三周期第VIA族.
(6)写出④的最高价氧化物的水化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式.
| A. | 乙二醇的水溶液凝固点很低,可作汽车发动机的抗冻剂 | |
| B. | 丙三醇的沸点比乙二醇的沸点高,可用于配制化妆品 | |
| C. | 这两种多元醇都易溶于水,但难溶于有机溶剂 | |
| D. | 丙三醇可以制造炸药,乙二醇是制涤纶的主要原料 |
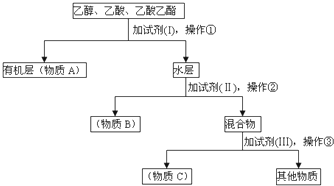
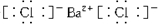 ,③的电子式是
,③的电子式是 .
.