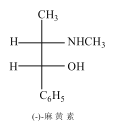
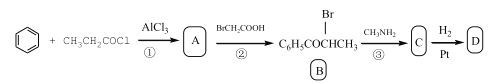
题目内容
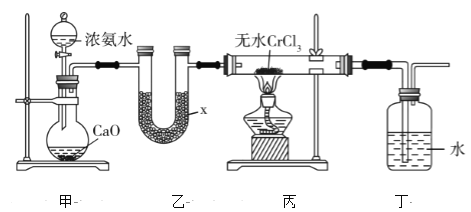
【题目】已知反应: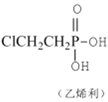 +4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O。可用如图装置和给定的试剂制取1,2-二溴乙烷(其信息如下:相对分子质量为188、无色液体,密度2.18gcm-3,熔、沸点分别为9.79℃、131.4℃,不溶于水)。试管d中装有液溴(表面覆盖少量水)。回答下列问题:
+4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O。可用如图装置和给定的试剂制取1,2-二溴乙烷(其信息如下:相对分子质量为188、无色液体,密度2.18gcm-3,熔、沸点分别为9.79℃、131.4℃,不溶于水)。试管d中装有液溴(表面覆盖少量水)。回答下列问题:
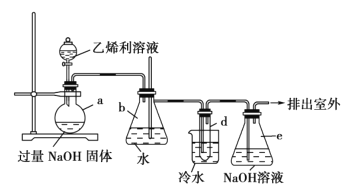
(1)仪器b的名称为______;其中长玻璃导管的作用是______。
(2)e装置的作用是______;其中所发生反应的离子方程式为______。
(3)试管d中发生反应的化学方程式为______。若用冰水代替烧杯中的冷水,可能引起的不安全后果是______。
(4)实验消耗40%乙烯利(摩尔质量为Mg·mol-1)溶液50g,制得产品mg,则乙烯利合成1,2-二溴乙烷的产率为______(用含M、m的代数式表示)。
【答案】锥形瓶 平衡体系压强,防止液体倒吸 吸收溴蒸气 Br2+2OH-=Br-+BrO-+H2O H2C=CH2+Br2→CH2BrCH2Br 温度太低造成生成的1,2-二溴乙烷凝固,导致试管d中长导管堵塞 ![]()
【解析】
由题中信息可知,a为制取乙烯的装置;b为安全瓶其作用可以检查实验进行中导管d是否发生堵塞和防止液体倒吸;d装置是探究乙烯与溴水反应的装置;e装置是尾气吸收装置,防止污染环境。
(1)根据题中给出的装置图可知仪器b为锥形瓶,其中长玻璃导管与外界相通,作用是平衡体系压强,防止液体倒吸;答案为锥形瓶,平衡体系压强,防止液体倒吸。
(2)因为溴蒸气有毒,需要使用尾气吸收装置,氢氧化钠溶液能够与溴反应,所以e装置用氢氧化钠溶液吸收挥发的溴蒸气,防止污染大气,Br2与NaOH溶液发生反应生成溴化钠、次溴酸钠和水,其离子方程式为Br2+2OH-=Br-+BrO-+H2O;答案为吸收溴蒸气,Br2+2OH-=Br-+BrO-+H2O。
(3)在试管d中乙烯与溴水发生加成反应,生成1,2-二溴乙烷,化学方程式为H2C=CH2+Br2→CH2BrCH2Br,若用冰水代替烧杯中的冷水,温度太低造成生成的1,2-二溴乙烷(熔点为9.79℃)凝固会堵塞d中长导管;答案为H2C=CH2+Br2→CH2BrCH2Br,温度太低造成生成的1,2-二溴乙烷凝固,导致试管d中长导管堵塞。
(4)1,2-二溴乙烷的物质的量为![]() ,乙烯利的物质的量为
,乙烯利的物质的量为![]() ,可以计算出产率为
,可以计算出产率为![]() =
=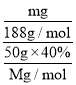 ×100%=
×100%=![]() ;答案为
;答案为![]()