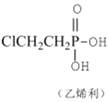
题目内容
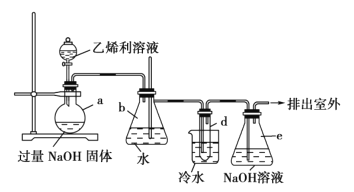
【题目】氮化铬(CrN)薄膜具有韧性高、耐磨性好、涂层结合强度高、更好的抗高温氧化性和抗腐蚀性以及内应力低等优点,在汽车工业、航空航天等领域取得了很好的应用效果。某化学兴趣小组利用下列装置进行氮化铬的制备(部分夹持装置已略),回答下列问题:
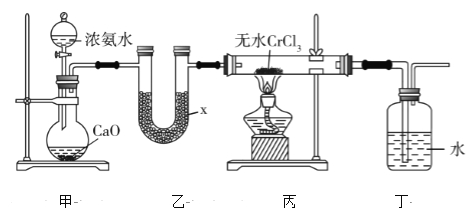
(1)仪器x的名称为________,x中盛有的试剂为干燥剂,该干燥剂可以是________(填字母)。
a.浓硫酸 b.碱石灰 c.CaO d.无水CaCl2
(2)装置甲中CaO可用NaOH固体代替,其原因是_______________________________________________。
(3)若装置丙玻璃管中产生大量白烟,则发生反应的化学方程式为__________________________________。
(4)装置丁洗气瓶中水的作用是________________________________________。该装置是否合适?合适则写出合适的理由,不合适则说明改进措施:_____________________________________________________
(5)实验前,在装置丙中加入15.850g CrCl3,实验结束后,取出装置丙中的固体加热至质量不再减少,称量剩余固体质量为7.525g,则制备的产品纯度为______%(保留小数点后一位)。
【答案】U形管(或U形干燥管) be NaOH溶于水放热,且电离出OH-,促使NH3·H2O分解生成NH3 ![]() 吸收尾气HCl或NH3 不合适,将丁中插入水中的导管改为倒扣漏斗,使漏斗下缘刚好和液面相平或在装置丙和装置丁之间增加一个安全瓶 78.9
吸收尾气HCl或NH3 不合适,将丁中插入水中的导管改为倒扣漏斗,使漏斗下缘刚好和液面相平或在装置丙和装置丁之间增加一个安全瓶 78.9
【解析】
本题以氨气的实验制备、性质和新信息下的反应方程式的书写以及有关产物的纯度计算,重点是在CrCl3与NH3的反应方程式的推断,一是注意目标产物为CrN,二是白烟为NH4Cl固体小颗粒,这个在学习氨气的检验过程中已经熟知,故难度不大。产物纯度计算过程中利用差量法进行较为简单。
(1)由仪器x的构造特点及在实验中的作用可知其名称是U形干燥管或U形管。NH3为碱性气体,应用碱性干燥剂,b、c项正确;因NH3与浓硫酸和CaCl2均能反应,故不能用浓硫酸和CaCl2作为干燥NH3的干燥剂,故答案为:U形干燥管或U形管,bc;
(2)氨水中存在平衡:![]() ,NaOH溶于水放热,且电离出OH-,促使NH3·H2O分解生成NH3,故答案为:NaOH溶于水放热,且电离出OH-,促使NH3·H2O分解生成NH3;
,NaOH溶于水放热,且电离出OH-,促使NH3·H2O分解生成NH3,故答案为:NaOH溶于水放热,且电离出OH-,促使NH3·H2O分解生成NH3;
(3)装置丙玻璃管中的物质为CrCl3,另外通入NH3,产生大量白烟是NH4Cl固体小颗粒,目标产物为CrN,故化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)HCl、NH3在水中溶解性极好,可用水作为二者的尾气吸收剂。装置丁中导管直接插入水中,容易引起倒吸,为防止液体倒吸,可将插入水中的导管改为倒扣漏斗,使漏斗下缘刚好和液面相平或在装置丙和装置丁之间增加一个安全瓶,故答案为:吸收尾气HCl或NH3 不合适,将丁中插入水中的导管改为倒扣漏斗,使漏斗下缘刚好和液面相平或在装置丙和装置丁之间增加一个安全瓶;
(5)利用差量法计算:
 则x=5.94,
则x=5.94,
纯度为![]() ,故答案为:78.9%。
,故答案为:78.9%。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O是一种光敏材料,下面是一种制备草酸合铁酸钾晶体的实验流程。

已知:(NH4)2SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO4·7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | ― |
(NH4)2SO4·FeSO4·6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)废铁屑在进行“溶解1”前,需用在5% Na2CO3溶液中加热数分钟,并洗涤干净。Na2CO3溶液的作用是________。
(2)“溶解1”应保证铁屑稍过量,其目的是___________。“溶解2”加“几滴H2SO4”的作用是________。
(3)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、________、过滤、用乙醇洗涤、干燥。用乙醇洗涤的目的是____________。
(4)“沉淀”时得到的FeC2O4·2H2O沉淀需用水洗涤干净。检验沉淀是否洗涤干净的方法是_______。
(5)“结晶”应将溶液放在黑暗处等待晶体的析出,这样操作的原因是__________。
(6)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤[备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250 mL待测液。
步骤2:用移液管移取25.00 mL待测液于锥形瓶中,加入稀H2SO4酸化,_________,C2O42-转化为CO2被除去。
步骤3:向步骤2所得溶液中______________。
步骤4:用c mol·L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液。
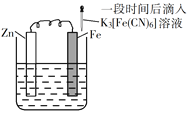
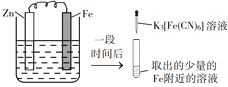
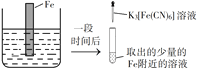
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼