题目内容
【题目】利用H2还原铁的氧化物并确定其组成的装置如图所示(Zn粒中往往含有硫化物等杂质,焦性没食子酸溶液可吸收少量氧气)。
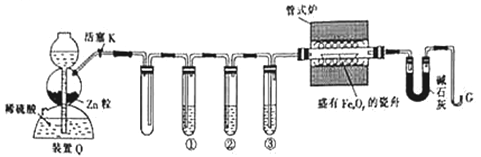
回答下列问题:
(1)装置Q(启普发生器)用于制备H2,还可用于_____(填字母,下同)。
A.生石灰与浓氨水制NH3 B.过氧化钠与水制O2
C.硫化铁固体与稀硝酸制H2S D.大理石与稀盐酸制CO2
(2)①②③中依次盛装的试剂为__________________。
A.KMnO4酸性溶液、浓H2SO4、焦性没食子酸溶液
B.焦性没食子酸溶液、浓H2SO4、KMnO4酸性溶液
C. KMnO4酸性溶液、焦性没食子酸溶液、浓H2SO4
KMnO4酸性溶液中发生反应的离子方程式为_____________。
(3)“加热管式炉”和“打开活塞K”这两步操作应该先进行的是__________,在这两步之间还应进行的操作是_______________。
(4)反应过程中G管逸出的气体是___________,其处理方法是___________。
(5)结束反应时,应该___________,待装置冷却后称量并记录相应数据。
(6)假设反应完全后瓷舟中的固体只有Fe单质,实验中测得了下列数据: ①瓷舟的质量为30.4g;②瓷舟和FexOy的总质量为42.0g;③反应前U形管及内盛物的总质量为98.4g;④反应后U形管及内盛物的总质量为102.0g。由以上数据计算并确定该铁的氧化物的化学式为____________。
【答案】 D C 8MnO4-+5H2S+14H+=8Mn2++5SO42-+12H2O 打开活塞K 检验H2 的纯度 氢气(或H2) 在G管口处放置一个点燃的酒精灯 先停止加热,冷却至室温后,再关闭活塞K Fe3O4
【解析】H2还原铁的氧化物,装置Q用于制备氢气,因盐酸易挥发,则①、②、③应分别用于除去HCl、H2S、氧气和水,得到干燥的氢气与铁的氧化物在加热条件下反应生成铁,实验结束后应先停止加热再停止通入氢气,以避免铁被重新氧化。
(1)装置Q(启普发生器)用于制备H2。A.生石灰与浓氨水制NH3时生成的氢氧化钙微溶于水,会堵塞启普发生器,错误;B.过氧化钠能够与水剧烈反应,放出大量的热,不能用启普发生器作为反应装置,错误;C.稀硝酸具有强氧化性,硫化铁固体与稀硝酸不能反应制得H2S,应该选用稀硫酸,错误;D.大理石的主要成分为碳酸钙,不溶于水,与稀盐酸制CO2可以选用启普发生器作为反应装置,正确;故选D;
(2)装置Q用于制备氢气,因盐酸易挥发,则①、②、③应分别用于除去HCl、H2S、氧气和水,得到干燥的氢气与铁的氧化物在加热条件下反应生成铁,应最后通过浓硫酸干燥,①②③中依次盛装的试剂为KMnO4酸性溶液、焦性没食子酸溶液、浓HSO4;KMnO4酸性溶液用于吸收H2S,反应的离子方程式为8MnO4-+5H2S+14H+=8Mn2++5SO42-+12H2O,故答案为:C;8MnO4-+5H2S+14H+=8Mn2++5SO42-+12H2O;
(3)需要通过生成的氢气排尽装置中的空气,“加热管式炉”和“打开活塞K”这两步操作应该先进行的是打开活塞K,氢气中如果混有空气,加热时会发生爆炸,因此在这两步之间还应检验H2的纯度,故答案为:打开活塞K;检验H2的纯度;
(4)反应过程中G管逸出的气体是未反应的氢气,氢气极易燃烧,不能直接排空,可以在G管口处放置一个点燃的酒精灯,故答案为:氢气(或H2);在G管口处放置一个点燃的酒精灯;
(5)实验结束后应先停止加热再停止通入氢气,以避免铁被重新氧化,故答案为:先停止加热,冷却至室温后,再关闭活塞K;
(6)U形管内的碱石灰是原来吸收生成的水蒸气,因此生成的水的质量为102.0g-98.4g=3.6g,物质的量为0.2mol,FexOy的质量=42.0g-30.4g=11.6g,其中含有O元素的物质的量为0.2mol,质量为0.2mol×16g/mol=3.2g,则铁元素的质量为11.6g-3.2g=8.4g,物质的量为![]() =0.15mol,因此
=0.15mol,因此![]() =
=![]() =
=![]() ,则该铁的氧化物的化学式为Fe3O4,故答案为:Fe3O4。
,则该铁的氧化物的化学式为Fe3O4,故答案为:Fe3O4。