题目内容
【题目】常温下,向25mL0.1mol·L-1MOH溶液中逐滴加入0.2mol·L-1HA溶液,中和滴定曲线如图所示(体积变化忽略不计)。回答下列问题:
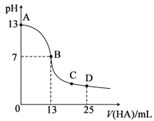
(1)写出MOH在水溶液中的电离方程式:___________。
(2)HA的电离平衡常数为___________ mol·L-l(写出计算结果)。
(3)D点时,溶液中c(A-)+c(HA)___________ 2c(M+)(填“>”“<”或“=”);溶液中离子浓度大小顺序为__________;若此时测得混合溶液的pH=a,则c(HA)+c(H+)=___________mol·L-l(用含字母a的计算表达式表示)。
【答案】 MOH=M++OH- 2.5×10-6 = c(A-)>c(M+)>c(H+)>c(OH-) 0.05+10a-14
【解析】试题分析:本题考查酸碱中和滴定图像的分析,电离方程式的书写,电离平衡常数的计算,溶液中粒子浓度的大小关系。
(1)由图像知,没有滴入HA溶液时,0.1mol/LMOH溶液常温下的pH=13,则MOH为强碱,MOH在水溶液中的电离方程式为:MOH=M++OH-。
(2)当加入13mLHA溶液时,溶液的pH=7,溶液中c(H+)=c(OH-)=1![]() 10-7mol/L,溶液中c(M+)=
10-7mol/L,溶液中c(M+)=![]() =
=![]() mol/L,根据电荷守恒c(M+)+c(H+)=c(OH-)+c(A-),此时溶液中c(A-)=c(M+)=
mol/L,根据电荷守恒c(M+)+c(H+)=c(OH-)+c(A-),此时溶液中c(A-)=c(M+)=![]() mol/L;根据A守恒,此时溶液中c(HA)=
mol/L;根据A守恒,此时溶液中c(HA)=![]() -
-![]() mol/L=
mol/L=![]() mol/L;HA的电离方程式为HA
mol/L;HA的电离方程式为HA![]() H++A-,HA的电离平衡常数Ka=[c(H+)·c(A-)]/c(HA)=
H++A-,HA的电离平衡常数Ka=[c(H+)·c(A-)]/c(HA)= mol/L=2.5
mol/L=2.5![]() 10-6mol/L。
10-6mol/L。
(3)D点,加入25mLHA溶液,依据反应MOH+HA=MA+H2O,充分反应后得到物质的量浓度均为0.05mol/L的MA和HA的混合液,溶液中物料守恒为c(A-)+c(HA)=2c(M+)。在溶液中存在HA的电离平衡和MA的水解平衡,由于溶液的pH![]() 7,溶液呈酸性,说明HA的电离程度大于A-的水解程度,弱酸的电离程度和水解程度都是微弱的,溶液中离子浓度由大到小的顺序为c(A-)
7,溶液呈酸性,说明HA的电离程度大于A-的水解程度,弱酸的电离程度和水解程度都是微弱的,溶液中离子浓度由大到小的顺序为c(A-)![]() c(M+)
c(M+)![]() c(H+)
c(H+)![]() c(OH-)。此时溶液中c(M+)=0.05mol/L,溶液的pH=a,溶液中c(H+)=10-amol/L,溶液中c(OH-)=10a-14mol/L;溶液中的物料守恒为c(A-)+c(HA)=2c(M+),溶液中的电荷守恒为c(M+)+c(H+)=c(A-)+c(OH-),两式相加消去c(A-)得,c(H+)+c(HA)=c(M+)+c(OH-)=0.05mol/L+10a-14mol/L=(0.05+10a-14)mol/L,即c(H+)+c(HA)=(0.05+10a-14)mol/L。
c(OH-)。此时溶液中c(M+)=0.05mol/L,溶液的pH=a,溶液中c(H+)=10-amol/L,溶液中c(OH-)=10a-14mol/L;溶液中的物料守恒为c(A-)+c(HA)=2c(M+),溶液中的电荷守恒为c(M+)+c(H+)=c(A-)+c(OH-),两式相加消去c(A-)得,c(H+)+c(HA)=c(M+)+c(OH-)=0.05mol/L+10a-14mol/L=(0.05+10a-14)mol/L,即c(H+)+c(HA)=(0.05+10a-14)mol/L。

 名校课堂系列答案
名校课堂系列答案【题目】从下表的阴、阳离子中选出适当的离子组成三种电解质(每种离子只能选用一次),用惰性电极对每种电解质溶液进行电解。回答下列问题:
阳离子 | H+、Na+、Ag+ |
阴离子 | Cl-、SO42-、NO3- |
(1)若阴极放出氢气,阳极放出氧气,且电解后溶液的pH变小,则所选用的电解质的化学式是___________,阴极的电极反应式为___________。
(2)若阴极析出金属,阳极放出氧气,则所选用的电解质的化学式是___________,阳极的电极反应式为_______________________________________________________________。
(3)用如图所示装置电解第三种电解质M的饱和溶液,写出该电解池中发生反应的总化学方程式:____________________________。