题目内容
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年,元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。
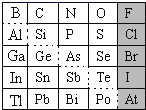
(1)根据元素周期律,推断:
①H3AsO4、H2SeO4的酸性强弱:H3AsO4___H2SeO4(填“>”、“<”或“=”)。
②氢化物的还原性:H2O___H2S(填“>”、“<”或“=”)。
(2)可在图中分界线(虚线部分)附近寻找___(填序号)。
A.优良的催化剂B.半导体材料C.合金材料D.农药
(3)①Se2Cl2常用作分析试剂,其电子式为___。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是___(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(4)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。
实验步骤 | 实验现象与结论 |
在试管中加入___,再加入___,将生成气体通过___洗气后,通入___; | 现象:___;结论:非金属性C>Si |
【答案】< < B ![]() AB CaCO3固体 盐酸 NaHCO3溶液 Na2SiO3溶液 生成白色胶状沉淀
AB CaCO3固体 盐酸 NaHCO3溶液 Na2SiO3溶液 生成白色胶状沉淀
【解析】
(1) ①同周期元素从左到右非金属性增强,非金属越强最高价含氧酸的酸性越强,非金属性:Se>As,酸性:H3AsO4<H2SeO4,故答案为:<;
②同主族元素从上到下非金属性减弱,非金属性越强形成的气态氢化物还原性越弱,非金属性:O>S,则氢化物的还原性:H2O<H2S,故答案为:<;
(2)图中分界线(虚线部分)为金属与非金属的交界处,一般在附近寻找半导体材料,故答案为:B;
(3)①Se2Cl2常,Cl为-1价,则Se为+1价,具有过氧化氢的类似结构,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
②A.由周期表结构可知,In在第五周期,Se在第四周期,原子的电子层数越多,半径越大,原子半径:In>Se,故A正确;
B.金属性从上到下逐渐增强,从左到右逐渐减弱,结合元素的位置可知,金属性:In>Te,Te>Se,因此In的金属性比Se强,故B正确;
C. Al和In同主族,同主族元素从上到下金属性增强,In的金属性比Al强,故C错误;
D.铟是第IIIA族,化合价为+3价,Se为第VIA族,化合价为-2价,硒化铟的化学式为In2Se3,故D错误;
故答案为:AB;
(4)设计实验比较C、Si的非金属性强弱顺序,应利用碳酸酸性强于硅酸证明,首先用盐酸与碳酸钙反应制取二氧化碳(不能选用硫酸与碳酸钙制取二氧化碳气体,因产生的硫酸钙微溶,会覆盖在碳酸钙表面影响反应进行),然后用碳酸氢钠溶液除去二氧化碳中混有的氯化氢,再将二氧化碳通入硅酸钠溶液中看是否出现白色胶状沉淀,
故答案为:CaCO3固体;盐酸;NaHCO3溶液;Na2SiO3溶液;生成白色胶状沉淀;