��Ŀ����
����Ŀ����ҵ�ϳɰ����Ʊ�����һ��������������������£�
��1����ҵ����ʱ����ȡ������һ����ӦΪ��CO(g)+H2O(g)![]() CO2(g)+H2(g)��
CO2(g)+H2(g)��
��t��ʱ����1L�ܱ������г���0.2molCO��0.3molˮ��������Ӧ����ƽ�����ϵ��c(H2)=0.12mol��L��1�����¶��´˷�Ӧ��ƽ�ⳣ��K=___��
�ڱ����¶Ȳ��䣬������ƽ����ϵ���ټ���0.1molCO������Ӧ���½���ƽ��ʱ��ˮ��������ת������(H2O)=___��
��2���ϳ����з�����ӦΪ��N2(g)+3H2(g)![]() 2NH3(g) ��H<0���±�Ϊ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����ɴ˿���֪������T1___573K���>������<����=������
2NH3(g) ��H<0���±�Ϊ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����ɴ˿���֪������T1___573K���>������<����=������
T/K | T1 | 573 | T2 |
K | 1.00��107 | 2.45��105 | 1.88��103 |
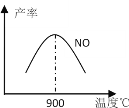
��3��NH3��O2�ڲ�ϵ���������´�145��Ϳ�ʼ��Ӧ��4NH3+5O2![]() 4NO+6H2O ��H=��905kJ��mol��1 ����ͬ�¶���NO������ͼ��ʾ���¶ȸ���900��ʱ��NO�����½��Ŀ���ԭ��___��
4NO+6H2O ��H=��905kJ��mol��1 ����ͬ�¶���NO������ͼ��ʾ���¶ȸ���900��ʱ��NO�����½��Ŀ���ԭ��___��
��4���������з�ӦΪ��3NO2+H2O![]() 2HNO3+NO�����������̿�������������Ҫ�����������ԭ����___��
2HNO3+NO�����������̿�������������Ҫ�����������ԭ����___��
��5�����᳧��β�����е��������������ֱ���ŷŽ���Ⱦ������Ŀǰ��ѧ��̽������ȼ�������еļ���Ƚ��������ﻹԭΪ������ˮ���䷴Ӧ����Ϊ��
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H=��574kJ��mol��1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ��H=��1160kJ��mol��1
�����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ��___��
���𰸡�1 50% < �¶ȸ���900��ʱ��ƽ�����淴Ӧ�����ƶ� ���������NOת��ΪNO2�����������ԭ�������� CH4��g��+2NO2��g��=CO2��g��+N2��g����H=��867kJ/mol
��������
��1����������ʽ���м��������ƽ��ʱ��Ũ�ȣ�������ƽ�ⳣ����ʽ���㣻
��2���÷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ���
��3����ͼ��֪��900��ʱ��Ӧ�ﵽƽ�⣬�����¶ȣ�ƽ�����淴Ӧ�����ƶ���
��4���������в��������������һ��������Ӧ��������NOת��ΪNO2������Ӧ��Ũ�ȣ���С������Ũ�ȣ�
��5�����ݸ�˹���ɼ���ɵá�
��1���������⽨����������ʽ��
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
��mol/L��0.2 0.3 0 0
�䣨mol/L��0.12 0.12 0.12 0.12
ƽ��mol/L��0.08 0.18 0.12 0.12
��ƽ�ⳣ��K=![]() =
=![]() =1���ʴ�Ϊ��1��
=1���ʴ�Ϊ��1��
����ˮ��������ת����Ϊx�������⽨����������ʽ��
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
��mol/L��0.3 0.3 0 0
�䣨mol/L��0.3x 0.3x 0.3x 0.3x
ƽ��mol/L��0.3-x 0.3-x 0.3x 0.3x
��ƽ�ⳣ��K�ɵù�ϵʽ![]() =
=![]() =1�����x=0.5����ˮ��������ת����Ϊ50%���ʴ�Ϊ��50%��
=1�����x=0.5����ˮ��������ת����Ϊ50%���ʴ�Ϊ��50%��
��2���÷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ�����ͣ���T1<573K���ʴ�Ϊ��<��
��3����ͼ��֪��900��ʱ��Ӧ�ﵽƽ�⣬�����¶ȣ�ƽ�����淴Ӧ�����ƶ���NO�����½����ʴ�Ϊ���¶ȸ���900��ʱ��ƽ�����淴Ӧ�����ƶ���
��4���������в��������������һ��������Ӧ��������NOת��ΪNO2������Ӧ��Ũ�ȣ���С������Ũ�ȣ�ʹƽ��������Ӧ�����ƶ������ԭ�������ʣ��ʴ�Ϊ�����������NOת��ΪNO2�����������ԭ�������ʣ�
��5������֪�Ȼ�ѧ����ʽ���α��Ϊ�٢ڣ��ɸ�˹���ɿ�֪��![]() �ɵ��Ȼ�ѧ����ʽ����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽCH4��g��+2NO2��g��=CO2��g��+N2��g�������H=
�ɵ��Ȼ�ѧ����ʽ����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽCH4��g��+2NO2��g��=CO2��g��+N2��g�������H=![]() =��867kJ/mol�� �ʴ�Ϊ��CH4��g��+2NO2��g��=CO2��g��+N2��g����H=��867kJ/mol��
=��867kJ/mol�� �ʴ�Ϊ��CH4��g��+2NO2��g��=CO2��g��+N2��g����H=��867kJ/mol��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�