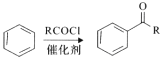
题目内容
【题目】下列事实合理且能用勒夏特列原理解释的是( )
A.在硫酸亚铁溶液中,加入铁粉以防止氧化变质
B.对2HI(g)![]() H2(g)+I2(g)平衡体系增加压强使颜色变深
H2(g)+I2(g)平衡体系增加压强使颜色变深
C.反应CO + NO2![]() CO2 +NO(正反应放热),升高温度使平衡向正方向移动
CO2 +NO(正反应放热),升高温度使平衡向正方向移动
D.用热的纯碱溶液洗去铁屑表面的油污时,去污效果好
【答案】D
【解析】
A项、在FeCl2溶液中加入铁粉防止氧化变质的原因是溶液中变质生成的铁离子和铁反应生成亚铁离子,不存在平衡的问题,不能用勒夏特列原理解释,故A错误;
B项、该反应是一个气体体积不变的反应,增大压强,平衡不移动,不能用勒夏特列原理解释,故B错误;
C项、该反应是一个放热反应,升高温度,平衡向逆反应方向移动,故C错误;
D项、碳酸钠在溶液中的水解反应是一个吸热反应,升高温度,平衡正向移动,溶液中氢氧根浓度增大,去污效果增强,能用勒夏特列原理解释,故D正确;
故选D。

【题目】丙烯(C3H6)是重要的有机化工原料。丙烷直接脱氢制丙烯发生的反应有:
反应Ⅰ:C3H8(g)C3H6(g)+H2(g) △H1
反应Ⅱ:2C3H8(g)3C2H4(g)+2H2(g) △H2
已知:①反应Ⅰ活化能Ea(Ⅰ)小于反应Ⅱ活化能Ea(Ⅱ);
②3种物质的燃烧热如下表:
C3H8(g) | C3H6(g) | H2(g) |
—2217.8kJ·mol-1 | —2058kJ·mol-1 | —285.8kJ·mol-1 |
(1)△H1=_______kJ·mol-1
(2)恒温恒容条件下,向密闭容器中充入1molC3H8(g),下列情况能说明丙烷脱氢制丙烯反应达到平衡状态的是______________。
A.该反应的H保持不变B.混合气体的平均摩尔质量保持不变
C.![]() 保持不变D.C3H8分解速率与C3H6消耗速率相等
保持不变D.C3H8分解速率与C3H6消耗速率相等
(3)一定温度下,向恒容密闭容器中充入总物质的量为4mol的丙烷和氢气混合气体(氢气的作用是活化催化剂)。反应相同时间,丙烯产率与进料气的关系如图1所示。图中曲线升高的原因是______________。
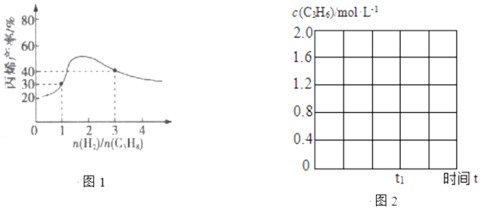
(4)①反应温度600℃,将10molC3H8(g)充入2L的刚性容器中,丙烷平衡转化率与丙烯的选择性均为40%,则反应Ⅰ的平衡常数K=______________。(保留2位小数)(丙烯的选择性=![]() ×100%)
×100%)
②600℃,丙烷脱氢反应在t1时达平衡,请在图2中画出该条件下c(C3H6)随时间t的变化图。______________
(5)含一氯丙烷(C3H7Cl)的废水可通过加入适量乙酸钠,设计成微生物电池除去,其原理如图3所示。写出N电极的电极反应式______________。

【题目】工业合成氨与制备硝酸一般可连续生产,流程如下:
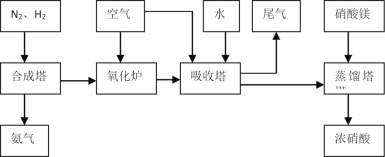
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g)。
CO2(g)+H2(g)。
①t℃时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=___。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α(H2O)=___。
(2)合成塔中发生反应为:N2(g)+3H2(g)![]() 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1___573K(填“>”、“<”或“=”)。
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1___573K(填“>”、“<”或“=”)。
T/K | T1 | 573 | T2 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
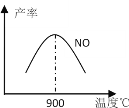
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3+5O2![]() 4NO+6H2O △H=-905kJ·mol-1 ,不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的可能原因___。
4NO+6H2O △H=-905kJ·mol-1 ,不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的可能原因___。
(4)吸收塔中反应为:3NO2+H2O![]() 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是___。
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是___。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:___。