��Ŀ����
����Ŀ��������Ԫ��W��X��Y��Z��ԭ�������������ӡ�M��N��P��Q�ֱ�����ЩԪ���γɵĵ��ʣ��ס��ҡ�����������������ЩԪ���γɵĶ�Ԫ��������У�����һ����ʹʪ��ĺ�ɫʯ����ֽ��������ɫ���壻����һ�ָ���ȼ�ϣ������Ԫ��������ͬ�����dz���������������������ʵ�ת����ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
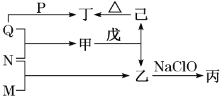
A.ԭ�Ӱ뾶�Ĵ�С��W<X<Y<Z
B.��ķе������
C.����ֻ���Ǽ��Թ��ۼ�
D.�ҿ���XԪ�ص�����������Ӧ��ˮ���ﷴӦ
���𰸡�D
��������
������Ԫ��W��X��Y��Z��ԭ�������������ӡ�M��N��P��Q�ֱ�����ЩԪ���γɵĵ��ʣ��ס��ҡ�����������������ЩԪ���γɵĶ�Ԫ��������У�����һ����ʹʪ��ĺ�ɫʯ����ֽ��������ɫ���壬����ΪNH3������һ�ָ���ȼ�ϣ������Ԫ��������ͬ�����ΪN2H4��M��NԪ�صĵ��ʷ�Ӧ����NH3����MΪH��NΪNԪ�أ����dz����������������ΪAl2O3������������Al2O3����ΪAl(OH)3��Q��P��Ӧ���ɶ�Al2O3����Q��PΪAl��O2����QΪO2�����ΪNO��NO���첻���������������Ͱ�������QΪAl����ΪAlN����ΪH2O��
���ݷ�����֪��WΪH��XΪN��YΪO��ZΪAl����ΪAlN����ΪNH3����ΪN2H4����ΪAl2O3����ΪH2O����ΪAl(OH)3��
A��ͬһ���ڴ�������ԭ�Ӱ뾶��С����ԭ�Ӱ뾶H��O��N��Al����A����
B��ˮ�ڳ�����ΪҺ̬������Ϊ���壬��ˮ�ķе�ϸߣ���B����
C��N2H4�����к��м��Լ��ͷǼ��Լ�����C����
D��XԪ�ص�����������Ӧ��ˮ����Ϊ���ᣬNH3�������ᷴӦ��������泥���D��ȷ��
�ʴ�ѡD��

����Ŀ����¯������ұ��������Ҫ��������������Ҫ��ӦΪ��
Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) ��H
2Fe(s)+3CO2(g) ��H
��Ӧ1�� Fe2O3(s)+3C(ʯī��s) ![]() 2Fe(s)+3CO(g) ��H1
2Fe(s)+3CO(g) ��H1
��Ӧ2�� C(ʯī��s)+CO2(g)![]() 2CO(g) ��H2
2CO(g) ��H2
�١�H= _________(�ú���H1�� ��H2����ʽ��ʾ��
�ڱ����¶Ȳ��䣬�ں��������н��з�Ӧ1���ﵽƽ��״̬���ٴγ���һ������CO (Fe����������ƽ��_________�ƶ�(������������ﵽ��ƽ���c(CO)��_________(��������С�����䡱)
(2)��T��ʱ����Ӧ Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g)��ƽ�ⳣ��K=64,��2L�����ܱ����������У��ֱ��±���ʾ�������ʣ���Ӧ����һ��ʱ���ﵽƽ�⡣
2Fe(s)+3CO2(g)��ƽ�ⳣ��K=64,��2L�����ܱ����������У��ֱ��±���ʾ�������ʣ���Ӧ����һ��ʱ���ﵽƽ�⡣
Fe2O3 | CO | Fe | CO2 | |
��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
��/mol | 1.0 | 1.5 | 1.0 | 1.0 |
�ټ�������CO��ƽ��ת����Ϊ_________
������˵����ȷ����_________������ĸ����
A��������ѹǿ�㶨��˵����Ӧ�ﵽƽ��״̬
B������Fe2O3���������CO��ת����
C����������CO��ƽ��ת���ʴ����ҵ�ƽ��ת����
D���������й����������ٸı䣬˵����Ӧ�ﵽƽ��״̬
��ȡ��ȷ�CO���ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У���װ������Fe2O3������Ӧ��ͬʱ��ֱ�ⶨ��ϵ��CO�����������CO%�������������淴Ӧ�¶ȣ�T���仯�Ĺ�ϵͼ�����ڴ��������ƽ��ʱ��������ƽ����Է��������淴Ӧ�¶ȣ�T���ı仯ʾ��ͼ��
_________

����Ŀ����ҵ�ϳɰ����Ʊ�����һ��������������������£�
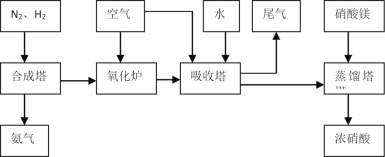
��1����ҵ����ʱ����ȡ������һ����ӦΪ��CO(g)+H2O(g)![]() CO2(g)+H2(g)��
CO2(g)+H2(g)��
��t��ʱ����1L�ܱ������г���0.2molCO��0.3molˮ��������Ӧ����ƽ�����ϵ��c(H2)=0.12mol��L��1�����¶��´˷�Ӧ��ƽ�ⳣ��K=___��
�ڱ����¶Ȳ��䣬������ƽ����ϵ���ټ���0.1molCO������Ӧ���½���ƽ��ʱ��ˮ��������ת������(H2O)=___��
��2���ϳ����з�����ӦΪ��N2(g)+3H2(g)![]() 2NH3(g) ��H<0���±�Ϊ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����ɴ˿���֪������T1___573K���>������<����=������
2NH3(g) ��H<0���±�Ϊ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����ɴ˿���֪������T1___573K���>������<����=������
T/K | T1 | 573 | T2 |
K | 1.00��107 | 2.45��105 | 1.88��103 |
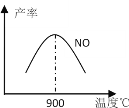
��3��NH3��O2�ڲ�ϵ���������´�145��Ϳ�ʼ��Ӧ��4NH3+5O2![]() 4NO+6H2O ��H=��905kJ��mol��1 ����ͬ�¶���NO������ͼ��ʾ���¶ȸ���900��ʱ��NO�����½��Ŀ���ԭ��___��
4NO+6H2O ��H=��905kJ��mol��1 ����ͬ�¶���NO������ͼ��ʾ���¶ȸ���900��ʱ��NO�����½��Ŀ���ԭ��___��
��4���������з�ӦΪ��3NO2+H2O![]() 2HNO3+NO�����������̿�������������Ҫ�����������ԭ����___��
2HNO3+NO�����������̿�������������Ҫ�����������ԭ����___��
��5�����᳧��β�����е��������������ֱ���ŷŽ���Ⱦ������Ŀǰ��ѧ��̽������ȼ�������еļ���Ƚ��������ﻹԭΪ������ˮ���䷴Ӧ����Ϊ��
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H=��574kJ��mol��1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ��H=��1160kJ��mol��1
�����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ��___��